La comprensión del átomo ha evolucionado significativamente desde las primeras ideas filosóficas hasta los modelos científicos modernos.
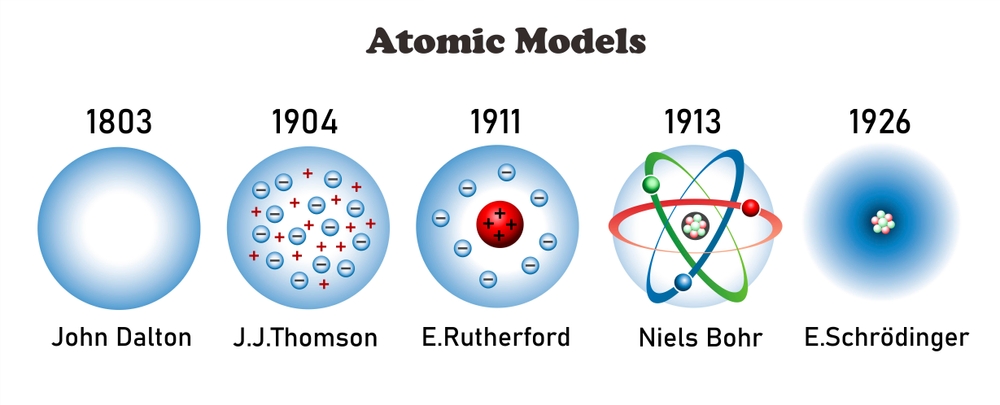
Cada modelo atómico ha aportado conocimientos esenciales que nos ayudan a entender mejor la estructura de la materia.
Objetivos de aprendizaje
- Describir la evolución de los modelos atómicos desde las primeras ideas filosóficas hasta los modelos científicos actuales.
- Identificar y explicar los experimentos clave que llevaron a los descubrimientos de las partículas subatómicas.
1. Primeras ideas filosóficas (Siglo V a.C.)
Demócrito y Leucipo
- Los filósofos griegos Demócrito y Leucipo propusieron que la materia estaba compuesta por partículas indivisibles llamadas “átomos” (del griego “átomos”, que significa indivisible).
- Inconsistencias: No tenían evidencia experimental, y sus ideas eran puramente filosóficas.
Aristóteles
- Descripción: Aristóteles rechazó la idea de los átomos de Demócrito y propuso que toda la materia estaba compuesta por cuatro elementos: tierra, agua, aire y fuego.
- Inconsistencias: Aunque ampliamente aceptada en su tiempo, la teoría de los cuatro elementos no podía explicar las reacciones químicas ni la diversidad de materiales.
2. Modelo de Dalton (1803)
Postulados:
- La materia está compuesta de átomos, que son partículas indivisibles e indestructibles.
- Todos los átomos de un elemento son idénticos en masa y propiedades.
- Los compuestos están formados por la combinación de átomos de diferentes elementos en proporciones fijas.
- Las reacciones químicas implican la reorganización de átomos, pero los átomos en sí no se transforman en otros elementos.
- Experimentos: Dalton basó su modelo en las leyes de la conservación de la masa y las proporciones definidas.
- Inconsistencias: No explica la existencia de partículas subatómicas ni las reacciones químicas que liberan energía.
3. Modelo de Thomson (1897)
- Propuso el modelo del “pudín de pasas”, donde los electrones (cargas negativas) están incrustados en una esfera positiva.
- Experimentos: Descubrió los electrones utilizando tubos de rayos catódicos.
- Inconsistencias: No explica la distribución de carga ni la estructura del núcleo atómico.
4. Modelo de Rutherford (1911)
- Rutherford propuso que el átomo tiene un núcleo central denso y positivo, con electrones orbitando alrededor.
- Experimentos: Realizó el experimento de la lámina de oro, donde partículas alfa atravesaban una lámina de oro, pero algunas se desviaban.
- Inconsistencias: No explica la estabilidad de las órbitas electrónicas ni los espectros de emisión.
5. Modelo de Bohr (1913)
- Propuso que los electrones orbitan en niveles de energía definidos y pueden saltar entre estos niveles.
- Experimentos: Utilizó los espectros de emisión del hidrógeno para su modelo.
- Inconsistencias: No explica el comportamiento de átomos más complejos ni la dualidad onda-partícula de los electrones.
6. Modelo de la Mecánica Cuántica (1926)
- Este modelo fue propuesto por Erwin Schrödinger y Werner Heisenberg
- Desarrollaron un modelo donde los electrones tienen propiedades de ondas y partículas, y su posición se describe por probabilidades.
- Experimentos: El principio de incertidumbre de Heisenberg y la ecuación de onda de Schrödinger.
- Inconsistencias: Aunque es el modelo más preciso hasta la fecha, es complejo y difícil de visualizar para átomos grandes.
Actividad: Concurso de modelos atómicos
Objetivo:
- Motivar a los estudiantes a construir modelos precisos de átomos fomentando la creatividad en la comprensión de la estructura atómica.
Materiales:
- Bolas de espuma de diferentes colores (para protones, neutrones y electrones)
- Plastilina
- Palillos de dientes o mondadientes
- Alambre o hilos
- Cartulina o papel grande
- Marcadores
- Reglas y tijeras
Procedimiento:
- Dividir a los estudiantes en equipos y asigna a cada equipo un elemento específico.
- Cada equipo debe construir un modelo tridimensional del átomo asignado, mostrando correctamente el número de protones, neutrones y electrones.
- Los estudiantes deben presentar sus modelos y explicar la estructura y características del átomo.
- Evalúa los modelos basándote en la precisión, creatividad y presentación.
- Premia al equipo con el mejor modelo atómico.
