
El símbolo nuclear es una forma abreviada de representar un elemento químico, mostrando su número atómico, número másico y el símbolo químico. Estos conceptos son fundamentales para comprender la estructura y las propiedades de los átomos. En esta clase, exploraremos qué son el número atómico y el número másico, y cómo se utilizan para escribir el símbolo nuclear de un elemento.
Objetivos de aprendizaje
- Definir y explicar el número atómico y el número másico.
- Utilizar el número atómico y el número másico para escribir el símbolo nuclear de un elemento.
1. Número atómico
El número atómico es el número total de protones presentes en el núcleo de un átomo. Se denota con la letra Z.
Este número es fundamental porque define el tipo de elemento. Por ejemplo, todos los átomos con un número atómico de 6 son átomos de carbono (C). Además, en un átomo neutro, el número de protones es igual al número de electrones. En otras palabras, el número de protones identifica un elemento de la misma manera que tus huellas dactilares te identifican a ti.

El número atómico determina las propiedades químicas del elemento y su posición en la tabla periódica.
Otros ejemplos:
- El hidrógeno tiene un número atómico de 1, lo que significa que tiene un protón en su núcleo.

- El oxígeno tiene un número atómico de 8, lo que significa que tiene ocho protones en su núcleo.

2. Número másico
El número másico es la suma del número de protones y neutrones en el núcleo de un átomo. Se denota con la letra A. A diferencia del número atómico, el número másico puede variar en átomos del mismo elemento debido a la presencia de isótopos. Los isótopos son átomos del mismo elemento que tienen diferentes números de neutrones.
Número másico (A) = Número de protones (Z) + Número de neutrones (n)
Ejemplo:
- Un átomo de carbono puede tener un número másico de 12 (6 protones + 6 neutrones) o 14 (6 protones + 8 neutrones), dependiendo del isótopo.
3. Símbolo nuclear

El símbolo nuclear es una notación que muestra el número atómico y el número másico de un elemento junto con su símbolo químico. La notación general es como se muestra en la imagen de arriba.
Ejemplo 1: Calcule el número de partículas subatómicas que hay en el átomo de aluminio.

- Considere el número másico A = 27 y el número atómico Z = 13.
- Se procede a calcular el número de neutrones restando el número másico menos el número atómico.
- El número de protones es el mismo número atómico.
- Por tratarse de un átomo neutro, el mismo número de electrones es igual al de protones.
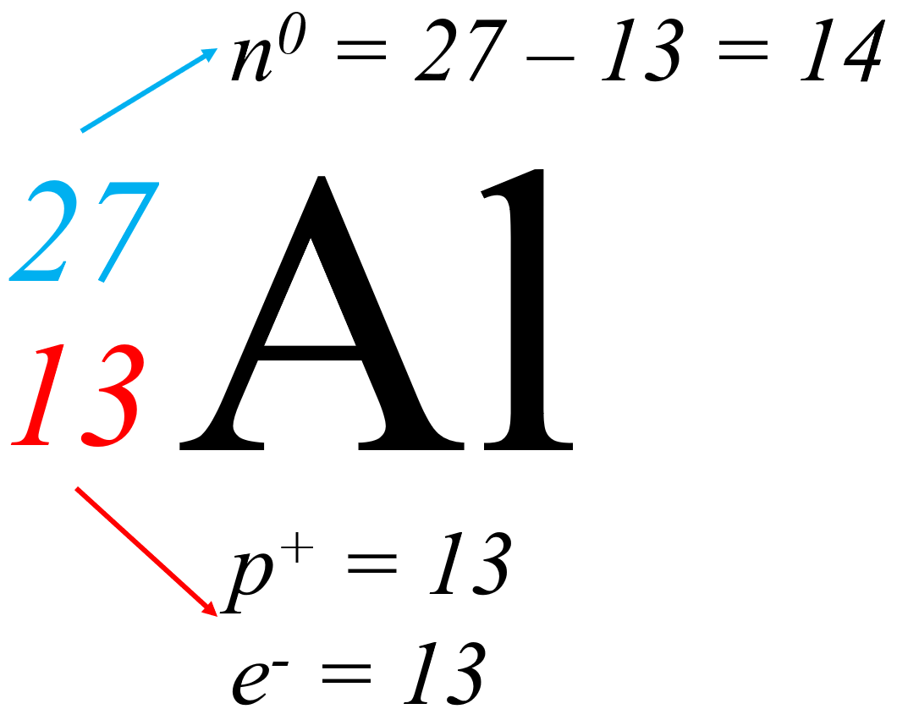
El símbolo nuclear es una herramienta esencial en la química para representar elementos y sus isótopos de manera concisa y clara. Comprender el número atómico y el número másico nos permite identificar y diferenciar átomos de diferentes elementos y sus variantes isotópicas. Este conocimiento es fundamental para estudiar las propiedades químicas y físicas de los elementos.
4. Iones
Un ion es un átomo o una molécula que ha perdido o ganado uno o más electrones, lo que le confiere una carga eléctrica neta. En un átomo neutro, el número de protones (cargas positivas) en el núcleo es igual al número de electrones (cargas negativas) que orbitan alrededor del núcleo. Cuando este equilibrio se altera por la pérdida o ganancia de electrones, se forma un ion. Hay dos tipos de iones: catión y anión.

Cuando un átomo pierde electrones, forma un ion positivo o catión, ya que el número de protones es ahora mayor que el número de electrones. Los iones negativos o aniones se forman cuando los átomos ganan electrones.
La magnitud de la carga depende del número de electrones perdidos o ganados. La pérdida o ganancia de electrones hace una gran diferencia en las propiedades químicas. Ingerimos iones de sodio (Na⁺) cada vez que comemos sal de mesa, mientras que los átomos de sodio (Na) son peligrosamente reactivos.
Un ion de aluminio se forma cuando el átomo pierde tres electrones. No hay cambios en los números atómicos o másicos de un ion porque el número de protones y neutrones permanece igual.

El oxígeno forma el ion óxido cuando el átomo gana dos electrones.

Ejercicios de práctica
1. Identifica las partículas subatómicas presentes en un átomo de 226Ra.
2. La mayoría de los elementos nutritivos en los alimentos están presentes en forma de iones. El ion calcio (40Ca2+), por ejemplo, es esencial para dientes y huesos saludables. Identifica las partículas subatómicas presentes en el ion.
3. Identifica la especie con 19 protones, 20 neutrones y 18 electrones.
4. Usa la tabla periódica para identificar las partículas subatómicas presentes en las siguientes especies:
| Especie | Número de protones | Número de neutrones | Número de electrones |
|---|---|---|---|
| 7Li | |||
| 1H | |||
| 14C | |||
| 19F– | |||
| 56Fe3+ |
