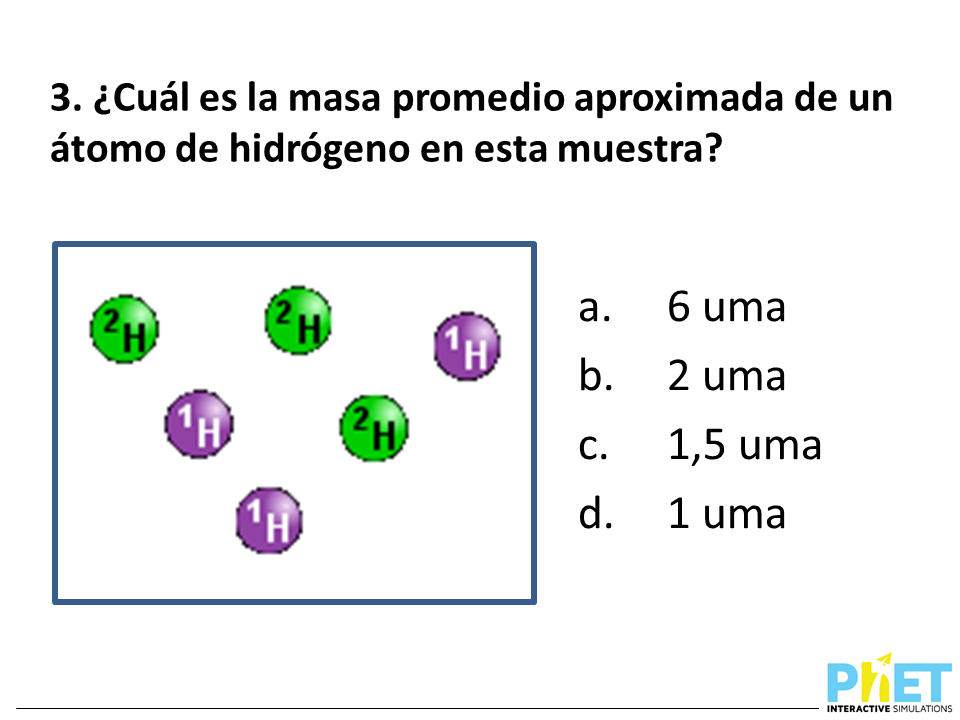
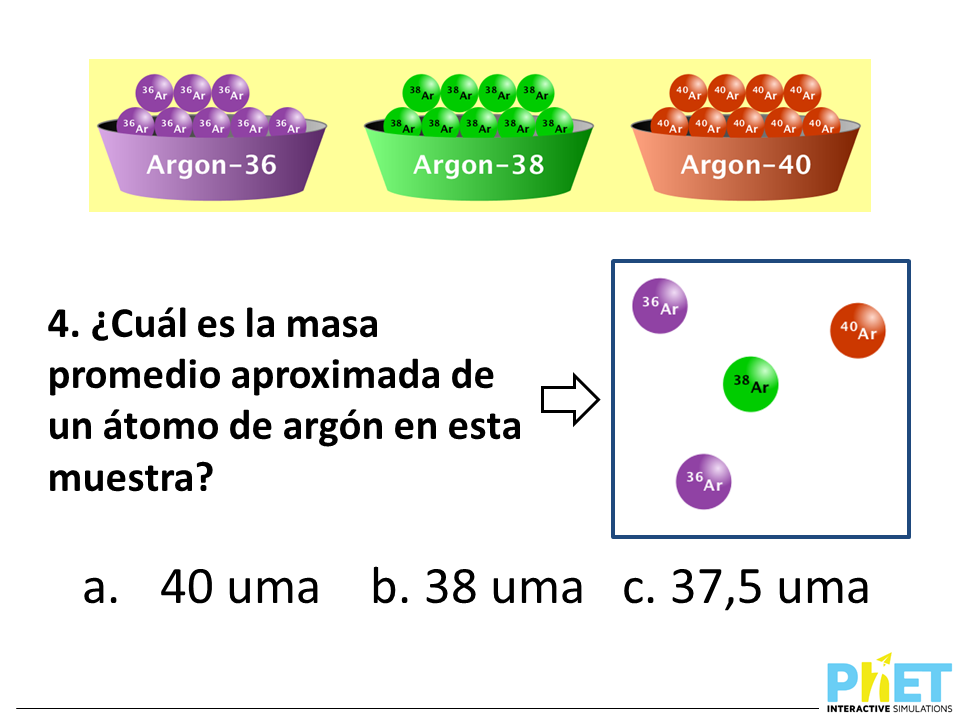
Los isótopos y la masa atómica relativa son conceptos clave en química que nos ayudan a entender mejor las propiedades y el comportamiento de los elementos.
Objetivos de aprendizaje
- Definir y explicar qué son los isótopos.
- Comprender y calcular la masa atómica relativa de un elemento.
1. Isótopos
Los isótopos son átomos del mismo elemento que tienen el mismo número de protones pero diferente número de neutrones. Esto significa que los isótopos de un elemento tienen el mismo número atómico (Z) pero diferentes números másicos (A). Los isótopos pueden ser estables o radiactivos.
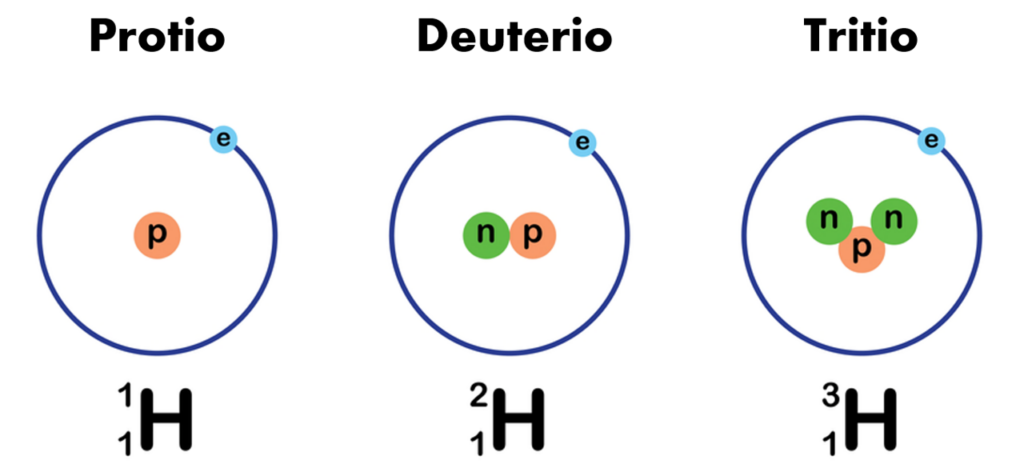
Por ejemplo, el hidrógeno tiene tres isótopos:
- Protio (1H): Tiene 1 protón, 1 electrón y 0 neutrones.
- Deuterio (2H): Tiene 1 protón, 1 electrón y 1 neutrón.
- Tritio (3H): Tiene 1 protón, 1 electrón y 2 neutrones.
La existencia de isótopos explica por qué algunos elementos tienen masas atómicas no enteras en la tabla periódica. Aunque los isótopos de un mismo elemento tienen propiedades químicas similares, pueden tener propiedades físicas diferentes.
2. Masa atómica relativa
La masa atómica relativa es el promedio ponderado de las masas de todos los isótopos de un elemento, teniendo en cuenta la abundancia de cada isótopo. Se calcula utilizando la fórmula:
masa atómica relativa = ∑(fracción de abundancia × masa del isótopo)
Ejemplo: Para el cloro (Cl), que tiene dos isótopos principales:
- Cloro-35 (³⁵Cl): Masa de 34.96885 uma, con una abundancia del 75.77%.
- Cloro-37 (³⁷Cl): Masa de 36.96590 uma, con una abundancia del 24.23%.
La masa atómica relativa del cloro se calcula así:
masa atómica relativa del cloro=(0.7577×34.96885)+(0.2423×36.96590)=35.453uma
La masa atómica relativa se expresa en unidades de masa atómica (uma) y se usa para calcular las cantidades de elementos en compuestos y reacciones químicas.
Ejercicios de práctica
1. El litio tiene dos isótopos que se encuentran de forma natural:
- ⁶Li: abundancia natural del 93%
- ⁷Li: abundancia natural del 7%
Calcula la masa atómica relativa del litio.
2. El silicio tiene tres isótopos que se encuentran de forma natural y sus detalles se presentan en la tabla a continuación.
| Isótopo | Abundancia natural (%) |
|---|---|
| ²⁸Si | 92.2 |
| ²⁹Si | 4.7 |
| ³⁰Si | 3.1 |
Calcula la masa atómica relativa del silicio.
Laboratorio:
1. Realice la siguiente actividad utilizando el simulador PhET. Conteste las preguntas debajo.