
Las auroras boreales se producen cuando partículas cargadas de alta energía provenientes del Sol son atraídas por el campo magnético de la Tierra hacia las regiones polares, donde excitan átomos y moléculas de los gases atmosféricos, haciendo que emitan luz.
El espectro atómico es un tema fundamental en la química para entender cómo los átomos absorben y emiten energía. A través del estudio de los espectros atómicos, los científicos pueden identificar los elementos presentes en una sustancia, comprender la estructura atómica y explorar las propiedades de los electrones en un átomo.
En esta clase, nos adentraremos en el concepto de espectro atómico, su importancia y cómo se relaciona con la estructura atómica.
Objetivo de aprendizaje
- Comprender y explicar el concepto de espectro atómico y cómo se relaciona con la estructura y comportamiento de los átomos.
1. Espectros atómicos
Los espectros atómicos son patrones de luz emitidos o absorbidos por átomos. Cuando los átomos son excitados, ya sea calentándolos o exponiéndolos a un campo eléctrico, sus electrones pueden saltar a niveles de energía más altos. Al volver a su estado fundamental, liberan energía en forma de luz. Esta luz puede separarse en sus componentes a través de un prisma, formando un espectro.
Cada elemento químico tiene un espectro atómico único, lo que permite su identificación precisa.
2. Tipos de espectros atómicos
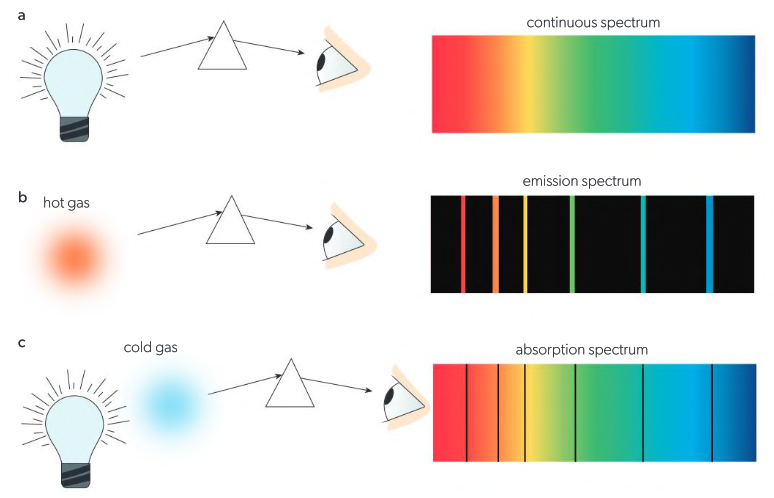
Los espectros generados a partir de (a) luz visible de todas las longitudes de onda (b) un gas calentado (c) luz visible de todas las longitudes de onda que pasa a través de un gas frío.
- Espectro continuo: se caracteriza por la presencia de todas las longitudes de onda dentro de un rango específico, sin interrupciones. Se observa, por ejemplo, en la luz blanca que, al pasar por un prisma, se dispersa en los colores del arcoíris. Este tipo de espectro se genera cuando una fuente de luz emite radiación en todas las longitudes de onda.
- Espectro de Emisión: Se produce cuando los electrones de un átomo liberan energía al regresar a un nivel de energía más bajo. Esta energía se emite en forma de luz, y el espectro de emisión muestra líneas brillantes en un fondo oscuro.
- Espectro de Absorción: Ocurre cuando los electrones de un átomo absorben energía y saltan a un nivel de energía más alto. El espectro de absorción muestra líneas oscuras en un espectro continuo de luz, ya que ciertas frecuencias han sido absorbidas por los átomos.
3. Aplicaciones
Los espectros atómicos tienen aplicaciones en diversas áreas de la ciencia y la tecnología. En astronomía, se utilizan para analizar la composición de estrellas y galaxias. En química analítica, permiten la identificación de elementos en muestras complejas.
Además, la espectroscopia es una herramienta esencial en la investigación de la estructura electrónica de los átomos, ayudando a explicar fenómenos como la energía de ionización y las afinidades electrónicas.
4. Espectros atómicos y la estructura del átomo
El estudio de los espectros atómicos ha sido crucial para el desarrollo de modelos atómicos. El modelo de Bohr, por ejemplo, se basa en la interpretación de las líneas espectrales del hidrógeno, donde los electrones se mueven en órbitas discretas alrededor del núcleo.
La mecánica cuántica también se apoya en los espectros atómicos para describir la probabilidad de encontrar electrones en diferentes regiones alrededor del núcleo, destacando la importancia de la dualidad onda-partícula en la materia.
Laboratorio: Ensayo a la llama
Objetivo:
Familiarizar a los estudiantes con el ensayo a la llama, una técnica analítica cualitativa que permite identificar elementos químicos basándose en el espectro de emisión de color que producen cuando se calientan. Los estudiantes aprenderán a realizar ensayos a la llama de manera segura y efectiva para identificar metales alcalinos y alcalinotérreos.
Materiales necesarios
- Mecheros
- Pinzas de metal
- Alambres de platino o asas de nicromo
- Soluciones de cloruros de diferentes metales (como sodio, potasio, calcio, cobre, etc.)
- Gafas de seguridad
- Guantes de laboratorio
Introducción teórica
Explica la teoría detrás del ensayo a la llama:
- Principio: Cuando un elemento químico se calienta en la llama, los electrones se excitan a niveles de energía más altos. Al regresar a su estado basal, emiten luz cuyo color es característico de cada elemento.
- Aplicaciones: Comúnmente usado para detectar la presencia de elementos metálicos en compuestos.
- Seguridad: Repasa las normas de seguridad en el laboratorio, enfatizando la importancia del uso de equipo de protección personal y manejo adecuado de sustancias químicas.
Procedimiento experimental
- Preparación:
- Limpia el alambre de platino o nicromo calentándolo en la llama hasta que no produzca coloración en la llama.
- Deja enfriar el alambre antes de sumergirlo en la solución del metal a testear.
- Ensayo:
- Sumerge el alambre limpio en la solución de cloruro del metal que se va a testear.
- Coloca el alambre en la parte más caliente de la llama y observa el color que se produce.
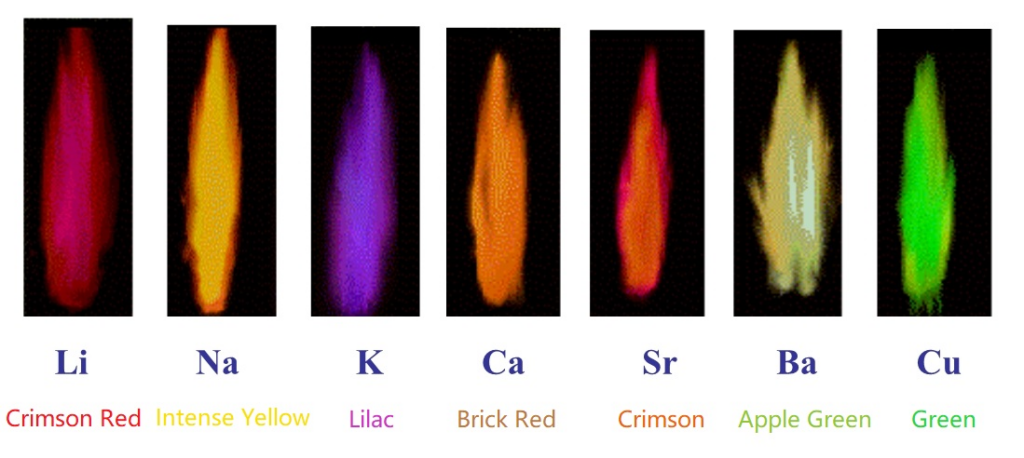
- Registra el color observado y compáralo con una tabla de referencia de colores de llama para diferentes elementos.
- Identificación:
- Repite el procedimiento con diferentes soluciones de metales.
- Asegúrate de limpiar el alambre entre cada ensayo para evitar contaminación cruzada.
Ejercicios de clase
- Observación y registro: Los estudiantes deben anotar el color observado para cada metal y buscar el elemento correspondiente utilizando una tabla de colores de llama.
- Discusión: Analizar por qué algunos elementos tienen colores de llama específicos y discutir cómo las configuraciones electrónicas influyen en los colores observados.
