En la clase anterior, aprendimos que un compuesto se forma gracias a una reacción química, lo que significa que cada una de sus partes individuales ya no conserva sus propiedades.
Por ejemplo, el sodio (Na) es un metal plateado altamente reactivo y el cloro (Cl) es un gas tóxico amarillo-verde a temperatura ambiente. Pero cuando se combinan químicamente para formar NaCl, el resultado es la sal de mesa, algo que se puede consumir de manera segura todos los días.
Objetivo de aprendizaje
- Distinguir entre compuestos y mezclas, identificando ejemplos de cada uno.
- Comprender los diferentes tipos de mezclas y conocer algunas técnicas para separarlas.

1. Mezclas
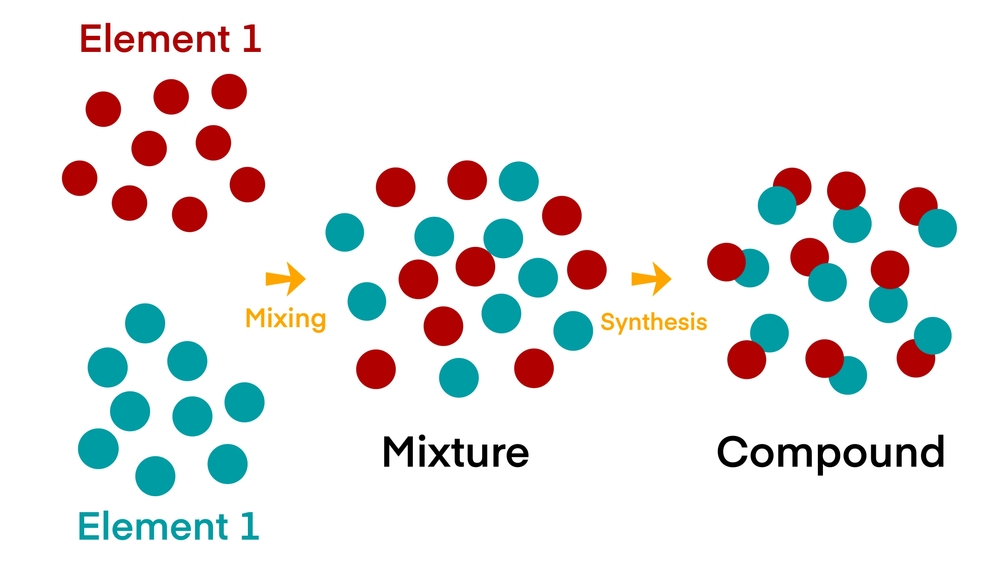
Una mezcla está formada por dos o más sustancias diferentes que se combinan. Las sustancias no están unidas químicamente, lo que significa que una mezcla se puede separar en sus partes originales.
Un ejemplo cotidiano de una mezcla es el aderezo para ensaladas hecho de aceite, vinagre y tal vez hierbas o jugo de limón.
Tipos de mezclas:
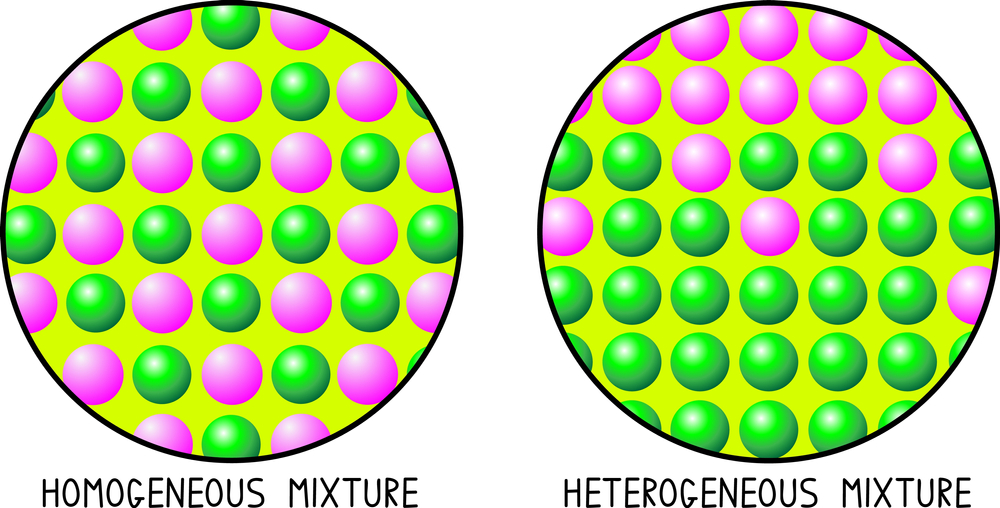
A. Mezclas homogéneas
Es una mezcla en la que las sustancias están distribuidas uniformemente y no se pueden distinguir a simple vista.
Ejemplos de mezclas homogéneas:
- Agua salada: agua y sal.
- Aire: mezcla de gases como nitrógeno y oxígeno.
- Acero inoxidable: hierro y carbono.
- Vinagre: agua y ácido acético.
- Alcohol en agua: mezcla de etanol y agua.
B. Mezclas heterogéneas:
Es una mezcla en la que las sustancias no están distribuidas uniformemente y se pueden distinguir a simple vista.
Ejemplos de mezclas heterogéneas
- Ensalada: vegetales variados.
- Arena y agua: arena dispersa en agua.
- Granola: mezcla de avena, nueces y frutas secas.
- Piedras en la playa: diferentes tipos y tamaños de piedras.
- Aceite y agua: líquidos inmiscibles que forman dos capas distintas.
2. Separación de Mezclas
A veces se quiere separar las mezclas para recuperar sus componentes originales. Para hacerlo, se deben separar por métodos físicos. Estos procesos, conocidos como técnicas de separación de mezclas, se muestran a continuación:
A. Filtración:
Utilizada para separar sólidos de líquidos en mezclas heterogéneas. En este proceso, la mezcla se pasa a través de un filtro que permite el paso del líquido pero retiene las partículas sólidas. Por ejemplo, filtrar arena mezclada con agua.
B. Destilación:
Utilizada para separar líquidos con diferentes puntos de ebullición. En este proceso, la mezcla se calienta hasta que uno de los componentes se evapora. El vapor se recoge y se condensa en un recipiente separado. Por ejemplo, destilar una mezcla de agua y alcohol.
C. Decantación:
Separación de líquidos inmiscibles (que no se mezclan). Se deja reposar la mezcla para que los componentes se separen en capas. Luego, se vierte cuidadosamente la capa superior. Por ejemplo, decantar una mezcla de agua y aceite.
D. Cromatografía:
Separación de componentes de una mezcla basada en sus diferentes velocidades de movimiento a través de un medio. En este proceso, los componentes se desplazan a diferentes velocidades y se separan en fases móviles y estacionarias. Por ejemplo, separar los pigmentos de tinta en papel de filtro.
E. Imantación:
Utilizada para separar componentes magnéticos de una mezcla. En este proceso, un imán se usa para atraer las partículas magnéticas y separarlas del resto de la mezcla. Por ejemplo, separar limaduras de hierro de arena.
F. Evaporación y cristalización:
Utilizada para separar un sólido disuelto en un líquido. Se calienta la mezcla hasta que el líquido se evapora (evaporación), dejando el sólido atrás en forma de cristal (cristalización). Por ejemplo, evaporar agua de una solución salina para obtener sal.
G. Sedimentación:
Proceso mediante el cual las partículas sólidas se asientan en el fondo de un líquido debido a la gravedad. Es comúnmente usado para separar mezclas heterogéneas de sólidos y líquidos. Por ejemplo, dejar que la arena se asiente en el fondo de un vaso con agua.
H. Centrifugación:
Técnica que utiliza la fuerza centrífuga para separar partículas de diferente densidad en una mezcla. En este proceso, la mezcla se coloca en un aparato llamado centrífuga, que gira a alta velocidad, haciendo que las partículas más densas se depositen en el fondo del recipiente. Por ejemplo, separar los componentes de la sangre.
Laboratorio: Técnicas de separación de mezclas
Objetivo:
- Aplicar técnicas de separación de mezclas para identificar sus componentes.
- Comprender los principios detrás de cada técnica de separación.
Materiales:
- Arena
- Sal de mesa (cloruro de sodio)
- Sulfato de cobre
- Agua
- Aceite
- Cucharas
- Papel de filtro
- Embudo de separación
- Vasos de precipitados
- Matraz Erlenmeyer
- Mechero de alcohol
- Pinzas
- Varillas de vidrio
- Probeta
- Gradilla
- Tubos de ensayo
- Soporte para tubos de ensayo
- Placa de evaporación
- Vidrio reloj
Procedimiento:
Parte 1: Filtración
- Preparación de la mezcla:
- Mezclar una cucharada de arena y una cucharada de sal con 100 ml de agua en un vaso de precipitados.
- Filtración:
- Colocar un papel de filtro en un embudo y este, a su vez, sobre un matraz Erlenmeyer.
- Verter la mezcla de arena y sal en el embudo.
- Anotar sus observaciones.
Parte 2: Evaporación
- Preparación de la mezcla de sulfato de cobre:
- Disolver una cucharada de sulfato de cobre en 100 mL de agua en un vaso de precipitados.
- Remover hasta que el sulfato de cobre esté completamente disuelto.
- Evaporación:
- Colocar la solución de sulfato de cobre en una placa de evaporación.
- Usar un mechero de alcohol para calentar la placa de evaporación hasta que el agua se evapore completamente.
- Anotar sus observaciones.
Parte 3: Decantación
- Preparación de la mezcla de agua y aceite:
- Mezclar 50 mL de agua y 50 mL de aceite en un vaso de precipitados.
- Decantación:
- Dejar reposar la mezcla hasta que el aceite y el agua se separen en dos capas distintas.
- Con cuidado, abrir la llave del embudo de decantación para liberar en un vaso de precipitación la capa inferior.
- Anotar sus observaciones.
Parte 4: Imantación
- Preparación de la mezcla:
- Mezclar limaduras de hierro y arena en un vidrio reloj.
- Separación de los componentes:
- Usar un imán fuerte para separar las limaduras de hierro de la arena.
- Pasar el imán por encima de la mezcla.
- Anotar sus observaciones.
Tabla de resultados:
| Técnica | Observaciones Iniciales | Observaciones Finales | Sustancia Separada |
|---|---|---|---|
| Filtración | |||
| Evaporación | |||
| Decantación | |||
| Imantación |
Conclusiones
- ¿Podrías separar la sal del agua usando solo filtración? Explica por qué.
- ¿Qué otra técnica podrías usar para separar el sulfato de cobre del agua sin evaporación? Justifica tu respuesta.
- ¿Qué pasaría si intentas decantar una mezcla de agua y vinagre? ¿Sería efectiva la separación?
- ¿Qué tipo de mezclas no se pueden separar utilizando imantación? ¿Por qué?
