El enlace iónico juega un papel crucial en la estructura y estabilidad de muchos compuestos que son esenciales en nuestra vida diaria. En esta clase, exploraremos cómo los átomos, al unirse para formar compuestos iónicos, pueden dar lugar a sustancias con características únicas. Entenderás el proceso mediante el cual los átomos alcanzan estabilidad electrónica mediante la transferencia de electrones, y cómo esta transferencia conduce a la formación de estructuras altamente ordenadas y estables.
Objetivo de aprendizaje
- Identificar y explicar los procesos de formación y las características de los enlaces iónicos.
1. Enlace iónico
El enlace iónico es un tipo de enlace químico que se forma cuando uno o más electrones se transfieren de un átomo a otro, resultando en la formación de iones. Estos iones tienen cargas opuestas y se atraen entre sí debido a fuerzas electrostáticas.
2. Formación de iones
Consideremos el clásico ejemplo del cloruro de sodio:
- Átomo de Sodio (Na): El sodio es un metal altamente reactivo que se encuentra en el grupo 1 de la tabla periódica, lo que indica que tiene un solo electrón en su capa de valencia. Este electrón es relativamente fácil de perder porque al hacerlo, el sodio alcanza una configuración electrónica más estable, similar a la de un gas noble (neón), quedando con su capa de valencia completa.
- Átomo de Cloro (Cl): El cloro es un no metal situado en el grupo 17 de la tabla periódica, lo que significa que tiene siete electrones en su capa de valencia. Necesita ganar un electrón para completar su octeto y alcanzar una configuración electrónica estable similar a la del argón, otro gas noble.
Transferencia de electrones
La formación de cloruro de sodio implica la siguiente transferencia de electrones:
- El electrón de valencia del sodio es transferido al átomo de cloro. Este movimiento se representa comúnmente con una flecha curva que apunta del sodio al cloro. Al perder un electrón, el sodio se convierte en un catión sodio (Na+), mientras que el cloro, al ganar un electrón, se convierte en un anión cloro (Cl–).
Atracción electroestática
Una vez formados, estos iones de cargas opuestas se atraen fuertemente entre sí. El ion sodio positivo y el ion cloro negativo establecen una atracción electrostática, lo que resulta en la formación de una estructura cristalina.
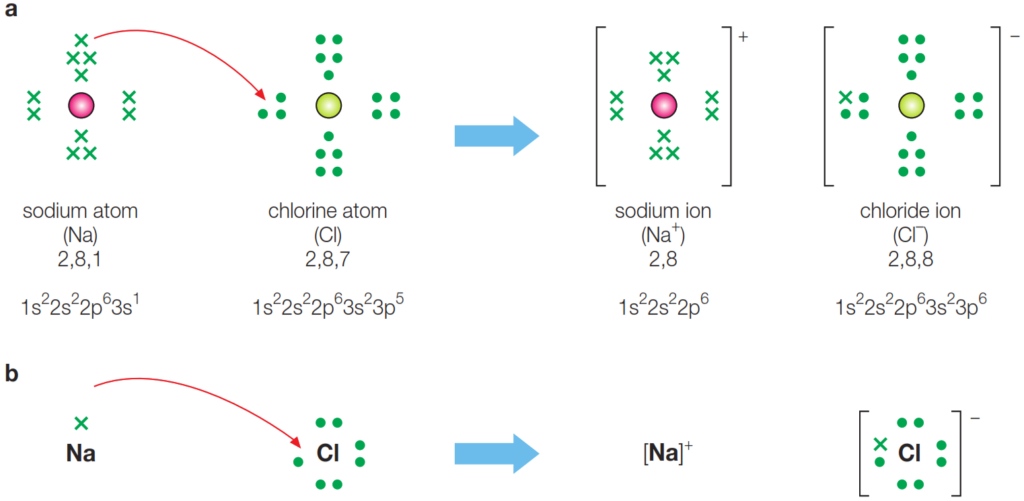
Enlace iónico en cloruro de sodio, NaCl, mostrando a) todos los electrones y b) solo los electrones externos o de valencia. La flecha curva indica la transferencia de un electrón del átomo de sodio al átomo de cloro.
3. Propiedades detalladas de los compuestos iónicos
- Punto de Fusión y Ebullición: Los enlaces iónicos son fuertes, lo que se traduce en puntos de fusión y ebullición muy altos.
- Solubilidad: Son solubles en disolventes polares como el agua debido a la capacidad del disolvente para estabilizar los iones a través de interacciones dipolo-ion.
- Conductividad Eléctrica: No conducen electricidad en estado sólido porque los iones están fijos en una red cristalina, pero conducen electricidad cuando se funden o se disuelven en agua, permitiendo el movimiento libre de los iones.
Ejemplos de compuestos iónicos
- Cloruro de Sodio (NaCl): Esencial para la vida, el NaCl se forma cuando el sodio (Na) pierde un electrón y el cloro (Cl) gana ese electrón, resultando en una estructura cristalina cúbica.
- Óxido de Magnesio (MgO): Conocido por su alta resistencia térmica, el MgO se forma cuando el magnesio pierde dos electrones que son ganados por el oxígeno, creando un compuesto con fuertes enlaces iónicos.
4. Predicción del tipo de enlace a partir de los valores de electronegatividad
La electronegatividad es una medida de la tendencia de un átomo a atraer hacia sí los electrones de un enlace químico. En la tabla periódica, la electronegatividad aumenta de izquierda a derecha y de abajo hacia arriba. Esta propiedad es crucial para predecir el tipo de enlace que se formará entre dos átomos diferentes.
Escala de Pauling
La escala de electronegatividad más utilizada es la desarrollada por Linus Pauling. En esta escala, el flúor tiene el valor más alto (4.0), lo que indica su fuerte tendencia a atraer electrones, mientras que elementos como el cesio y el francio tienen valores muy bajos (alrededor de 0.7), indicando una baja tendencia a atraer electrones.
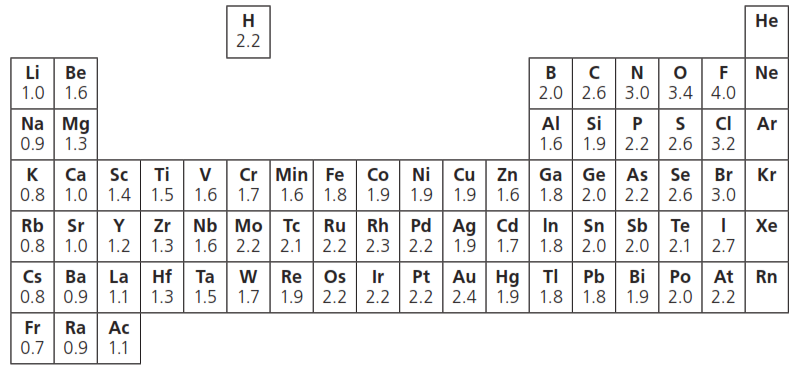
Valores de electronegatividad (Escala Pauling)
Diferencia de electronegatividad y tipo de enlace
- Enlace iónico: Se forma cuando la diferencia de electronegatividad entre los dos átomos es grande, generalmente mayor de 1.7. Este alto valor implica que uno de los átomos tiene mucha más fuerza para atraer electrones que el otro, resultando en una transferencia completa de electrones y la formación de iones.
- Enlace covalente polar: Ocurre cuando la diferencia de electronegatividad entre los dos átomos es moderada, generalmente entre 0.4 y 1.7. En este tipo de enlace, los electrones son compartidos de manera desigual entre los átomos, causando que uno de los átomos tenga una carga parcial negativa y el otro una carga parcial positiva.
- Enlace covalente no polar: Se forma cuando la diferencia de electronegatividad entre los dos átomos es pequeña, generalmente menor de 0.4. Los electrones se comparten de manera más equitativa entre los átomos, resultando en una distribución de carga más uniforme.
Ejemplos
- Cloruro de sodio (NaCl): Con una diferencia de electronegatividad de 2.3 (Cl: 3.2, Na: 0.9), este compuesto forma un enlace iónico.
- Agua (H2O): La diferencia entre el oxígeno (3.4) y el hidrógeno (2.2) es de 1.2, lo que resulta en un enlace covalente polar.
- Metano (CH4): Carbono (2.6) e hidrógeno (2.2) tienen una diferencia de electronegatividad de 0.4, formando enlaces covalentes no polares.
Ejercicios de práctica
1. Usando los valores de electronegatividad, predice el tipo de enlace en moléculas de flúor (F2), yoduro de hidrógeno (HI) y fluoruro de litio (LiF).
2. Deduce la diferencia en electronegatividad en los siguientes enlaces y predice el tipo de enlace: cloro-cloro, hidrógeno-flúor, carbono-cloro, berilio-cloro y carbono-hidrógeno.
