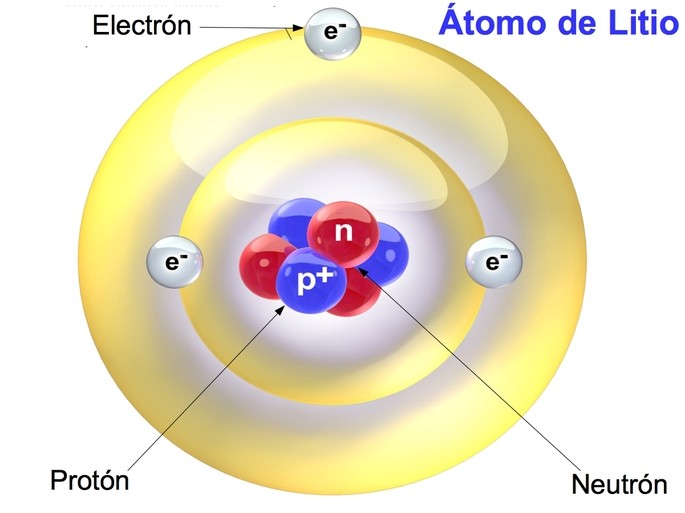
La imagen muestra un modelo simplificado del átomo de litio, con un núcleo compuesto de protones (p+) de color azul y neutrones (n0) de color rojo. Alrededor del núcleo, se observan electrones (e–) en órbita, indicados por esferas grises en niveles de energía amarillos. Las etiquetas identifican cada partícula subatómica, proporcionando una visión básica de la estructura atómica.
En el corazón de toda la materia se encuentra el átomo, la unidad básica que compone todos los elementos del universo. Aunque increíblemente pequeño, el átomo tiene una estructura compleja que ha fascinado y desafiado a científicos a lo largo de la historia. Comprender las partes del átomo es fundamental para explorar la química y la física que rigen nuestro mundo.
1. Partículas subatómicas
El átomo está compuesto por tres tipos principales de partículas subatómicas: protones, neutrones y electrones.
Los protones, con carga positiva, y los neutrones, sin carga eléctrica, forman el núcleo del átomo, una región central densa.
Los electrones, con carga negativa, orbitan alrededor del núcleo en regiones conocidas como orbitales, manteniendo un equilibrio eléctrico con los protones.
Esta estructura nos permite entender cómo los átomos se unen para formar moléculas, cómo interactúan con la luz y entre sí, y cómo estos procesos dan lugar a las propiedades y comportamientos de la materia.
2. Descubrimiento de las partículas subatómicas
- Electrones (1897)
- Descubridor: J.J. Thomson
- Experimento: Tubos de rayos catódicos
- Descripción: Thomson descubrió los electrones al observar rayos que eran desviados por campos eléctricos y magnéticos, indicando que estaban compuestos por partículas cargadas negativamente.
- Protones (1911)
- Descubridor: Ernest Rutherford
- Experimento: Experimento de la lámina de oro
- Descripción: Rutherford descubrió los protones al observar que algunas partículas alfa se desviaban significativamente al atravesar una lámina de oro, indicando la presencia de un núcleo pequeño y denso con carga positiva.
- Neutrones (1932)
- Descubridor: James Chadwick
- Experimento: Bombardeo de berilio con partículas alfa
- Descripción: Chadwick descubrió los neutrones al observar que el berilio emitía una radiación que no era desviada por campos eléctricos o magnéticos, indicando la presencia de una partícula neutra.
Cuadro comparativo de las partículas subatómicas
| Partícula | Carga | Masa | Ubicación |
|---|---|---|---|
| Protón | +1 | 1 uma | Núcleo |
| Neutrón | 0 (neutra) | 1 uma | Núcleo |
| Electrón | -1 | 1/1836 uma | Órbitas/Niveles de energía |
