Cada tipo de orbital atómico tiene una forma y energía características. El orbital s es esférico y tiene la energía más baja posible. Hay tres orbitales p, cada uno orientado de manera diferente. Existen cinco orbitales d y siete orbitales f, los cuales tienen una energía más alta que los orbitales s o p.
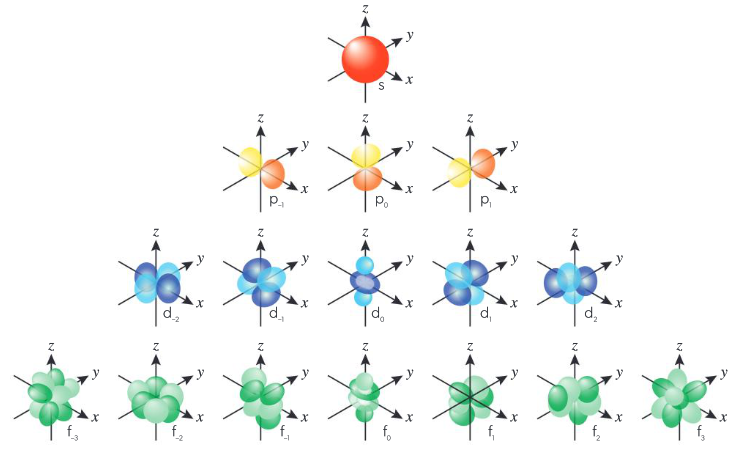
Esta representación muestra los subniveles s, p, d, y f son categorías que describen las formas y orientaciones de los orbitales atómicos donde los electrones se encuentran alrededor del núcleo de un átomo. Cada subnivel tiene una forma específica que influye en cómo los electrones se distribuyen y cómo interactúan los átomos con otros.
Cada nivel de energía definido por el número cuántico principal, n, puede contener n tipos de orbitales. Por ejemplo, para n = 1, solo existe el orbital s. Para n = 2, hay dos tipos de orbitales: s y p. Para n = 3, hay tres tipos: s, p y d. Para n = 4, hay cuatro tipos: s, p, d y f.
| Número cuántico principal (n) | Tipo de subnivel | Número de orbitales por tipo | Número total de orbitales por nivel de energía (n) | Número máximo de electrones por nivel de energía (2n²) |
|---|---|---|---|---|
| 1 | s | 1 | 1 | 2 |
| 2 | s p | 1 3 | 4 | 8 |
| 3 | s p d | 1 3 5 | 9 | 18 |
| 4 | s p d f | 1 3 5 7 | 16 | 32 |
Cada nivel de energía, definido por n, puede contener 2n2 electrones. El número de subniveles o tipos de orbitales atómicos es igual a n. Para n=4, hay cuatro tipos de orbitales (s, p, d y f) con un total de 16 orbitales atómicos, ocupados por un máximo de 2(4)2=32 electrones en total.
2. Diagramas de orbitales
Por convención, se utiliza una notación de “flechas dentro de una caja” llamada diagrama de orbitales, que representa cómo están dispuestos los electrones en los orbitales atómicos. La disposición de los electrones en los orbitales se llama configuración electrónica.
- Subnivel s: un cuadro que representa un orbital s.

- Subnivel p: tres cuadros que representan los tres orbitales px, py y pz.

- Subnivel d: cinco cuadros que representan los cinco orbitales d.

- Subnivel f: siete cuadros que representan los siete orbitales f.

En los diagramas de orbitales, cada cuadro representa un orbital. Este diagrama muestra el número de orbitales para cada subnivel. Se dibujan flechas en los cuadros para representar electrones. Un máximo de dos electrones puede ocupar cada orbital, por lo que cada cuadro tiene un máximo de dos “flechas”.
Los orbitales atómicos son regiones del espacio donde hay una alta probabilidad de encontrar electrones. Los electrones tienen carga negativa, y las cargas iguales se repelen entre sí, por lo que dos electrones no deberían poder ocupar la misma región del espacio.
La mecánica cuántica resuelve este problema utilizando una notación de espín ± para cada electrón. Un par de electrones con espines opuestos se comportan como imanes que se orientan en direcciones opuestas. Por lo tanto, cada cuadro del orbital se muestra con una flecha hacia arriba, ↑, y una flecha hacia abajo, ↓. Esto se conoce como el principio de exclusión de Pauli: Solo dos electrones pueden ocupar el mismo orbital atómico, y esos electrones deben tener espines opuestos.
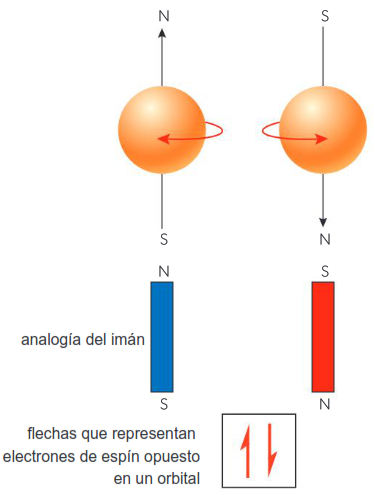
El espín del electrón se representa con una flecha hacia arriba (espín positivo) o hacia abajo (espín negativo)
Cada uno de los orbitales atómicos del mismo tipo en un subnivel tiene la misma energía. Los orbitales con la misma energía se denominan orbitales degenerados.
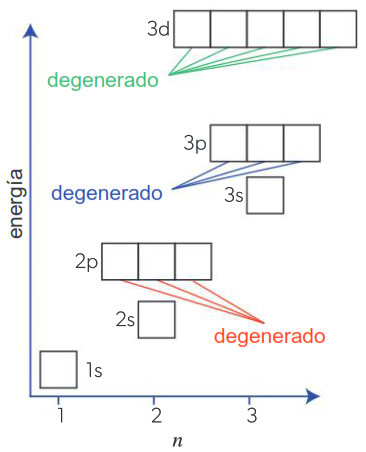
Los tres orbitales 2p son degenerados, ya que tienen la misma energía. Estos tres orbitales atómicos degenerados tienen menos energía que los tres orbitales 3p.
Por ejemplo, un átomo de boro (B) tiene cinco electrones, y su diagrama de orbitales se dibuja de la siguiente manera:

El único electrón 2p en el boro puede ocupar cualquiera de los tres orbitales, ya que tienen energías iguales. Los orbitales 2p degenerados se representan mediante cuadros unidos para mostrar su equivalencia en energía. Tradicionalmente, la media flecha se dibuja en el cuadro más a la izquierda, aunque esto es una cuestión de preferencia personal.
La regla de Hund establece que cada orbital degenerado en un subnivel debe estar ocupado individualmente antes de que cualquier orbital esté doblemente ocupado, y que todos los electrones en orbitales ocupados individualmente deben tener el mismo espín. Esto significa que los tres orbitales p deben tener un electrón con el mismo espín en cada uno de ellos antes de que cualquier orbital pueda estar ocupado doblemente con un electrón de espín opuesto.
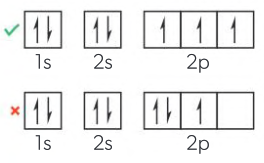
Los electrones están distribuidos uniformemente a través de los tres orbitales 2p degenerados en el nitrógeno antes de que un orbital esté doblemente ocupado.
El principio de Aufbau establece que a medida que se agregan electrones a los átomos, los orbitales de menor energía disponible se llenan antes que los orbitales de mayor energía. Los niveles de energía tercero y cuarto contienen orbitales d y f. Estos orbitales generalmente se llenan después de los orbitales s de los siguientes niveles porque tienen mayor energía. Como se muestra en la figura, el subnivel 3d tiene una energía mayor que 4s, pero menor que 4p, por lo que 4s se llena con electrones primero, seguido por 3d y finalmente 4p. Por la misma razón, los orbitales 4d se llenan después de 5s, y los orbitales 4f se llenan solo después de 6s.
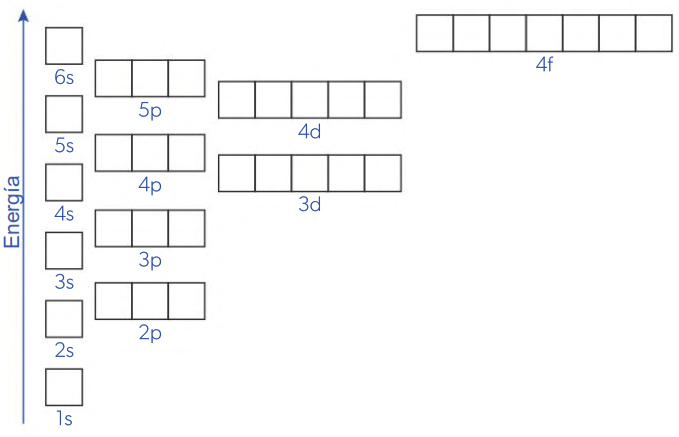
El subnivel 4s tiene una energía más baja y se llenará antes que el subnivel 3d.
Esto es consistente con los datos experimentales que muestran que el potasio (K) y el calcio (Ca) tienen electrones en el subnivel 4s, no en 3d.
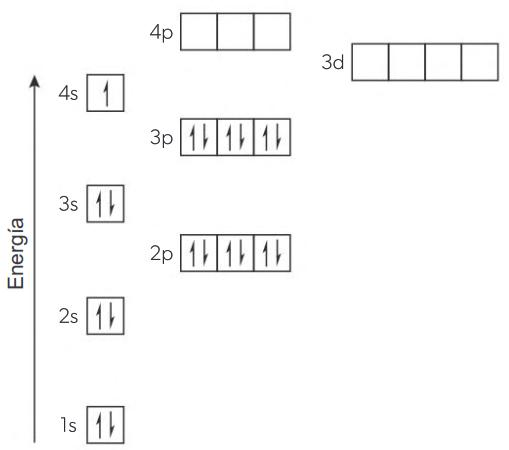
El diagrama de llenado orbital del potasio muestra el electrón más externo en el orbital 4s porque los orbitales 3d son de mayor energía.
En general, se observa el siguiente orden:
1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f < 5d < 6p…
El compartir y transferir electrones es fundamental para entender las reacciones químicas, por lo que es importante conocer la configuración electrónica de un átomo o ion. Hay tres formas de mostrar la configuración electrónica:
- Configuración electrónica completa
- Configuración electrónica condensada
- Diagrama de llenado de orbitales (notación de “flechas en cajas”)
3. Configuraciones electrónicas completas
Para escribir una configuración electrónica completa, utilizamos la tabla periódica y “construimos” los electrones en orbitales sucesivos de acuerdo con el principio de Aufbau, la regla de Hund y el principio de exclusión de Pauli.
4. Configuraciones electrónicas condensadas
A medida que aumenta el número atómico de un elemento, la configuración electrónica completa se vuelve más larga y escribirla puede ser tedioso. La química de los átomos y iones está mayormente determinada por sus electrones de valencia, es decir, los electrones más externos, en lugar de los electrones del núcleo interno.
Una forma más conveniente de escribir las configuraciones electrónicas es destacar los electrones de valencia y representar los electrones del núcleo interno con la misma configuración electrónica que el elemento del grupo 18 anterior (conocido como los gases nobles) en la tabla periódica:
Configuración electrónica condensada = [gas noble anterior] + electrones de valencia
La siguiente tabla muestra algunos ejemplos más de configuraciones electrónicas completas y condensadas.
| Elemento | Número Atómico | Configuración Electrónica Completa | Configuración Electrónica Condensada |
|---|---|---|---|
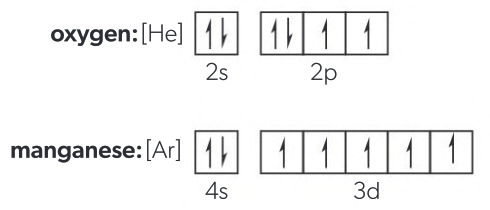
| Oxígeno (O) | 8 | 1s² 2s² 2p⁴ | [He] 2s² 2p⁴ |
| Neón (Ne) | 10 | 1s² 2s² 2p⁶ | [Ne] o [He] 2s² 2p⁶ |
| Manganeso (Mn) | 25 | 1s² 2s² 2p⁶ 3s² 3p⁶ 4s² 3d⁵ | [Ar] 4s² 3d⁵ |
| Bromo (Br) | 35 | 1s² 2s² 2p⁶ 3s² 3p⁶ 4s² 3d¹⁰ 4p⁵ | [Ar] 4s² 3d¹⁰ 4p⁵ |
Ejemplos de configuraciones electrónicas completas y condensadas para elementos seleccionados.
Los diagramas de orbitales también pueden acortarse a veces utilizando una configuración electrónica condensada. A continuación se muestran los diagramas de orbitales condensados para oxígeno y manganeso.
En resumen, la configuración electrónica es un concepto fundamental en química que nos permite entender cómo están dispuestos los electrones en un átomo. Esta distribución de electrones es crucial para predecir las propiedades químicas de los elementos y su comportamiento en las reacciones químicas. En esta clase, exploraremos cómo se distribuyen los electrones en los diferentes niveles y subniveles de energía, y cómo esta distribución influye en la reactividad y las propiedades de los elementos.
