1. Cuantización y fotones
Cada línea en el espectro de emisión de un elemento tiene una longitud de onda específica, que corresponde a una cantidad específica de energía. Esto se llama cuantización: la idea de que la radiación electromagnética viene en paquetes discretos, o cuantos. Un fotón es un cuanto de energía, el cual es proporcional a la frecuencia de la radiación de la siguiente manera:
E = h × f
Donde:
- E = la energía específica que posee el fotón, expresada en julios, J
- h = constante de Planck, 6,63 × 10-34 J · s
- f = frecuencia de la radiación, expresada en hertz (Hz) o segundos inversos, s⁻¹
2. El modelo atómico de Bohr
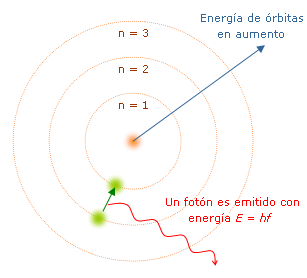
En 1913, Niels Bohr propuso un modelo del átomo de hidrógeno que explica cómo los electrones se mueven alrededor del núcleo. Los puntos principales de su teoría son:
- Los electrones solo pueden estar en ciertas órbitas alrededor del núcleo, llamadas órbitas estacionarias, y cada órbita tiene un nivel de energía específico.
- Cuando un electrón absorbe la cantidad correcta de energía, salta a una órbita más alta (más lejos del núcleo) y permanece allí durante un corto tiempo.
- Cuando el electrón regresa a una órbita más baja (más cerca del núcleo), emite un fotón de luz. La energía de este fotón es igual a la diferencia de energía entre las dos órbitas.
3. Importancia del modelo de Bohr
La teoría de Bohr fue importante porque resolvió un problema con el modelo anterior de Rutherford, que sugería que los electrones en movimiento deberían perder energía y caer en el núcleo, lo que destruiría el átomo. Bohr propuso que los electrones no pierden energía mientras están en sus órbitas estacionarias.
4. Energía cuantizada en el átomo de hidrógeno
En el modelo de Bohr, los electrones solo pueden tener ciertas energías bien definidas. Estas energías están cuantizadas, lo que significa que solo pueden tener ciertos valores específicos, como escalones en una escalera. La energía del electrón en el átomo de hidrógeno se puede calcular con la siguiente ecuación:
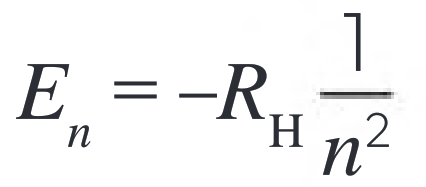
- En es la energía del electrón en una órbita con un número cuántico n.
- RH es la constante de Rydberg, que vale aproximadamente 2,18 × 10−18 J.
- n es el número cuántico principal, que puede ser 1, 2, 3, etc.
El número cuántico principal (n) nos dice en qué órbita está el electrón. Cuando n = 1, el electrón está en la órbita más cercana al núcleo, y tiene la menor energía posible. A esta se le llama estado fundamental del átomo.
Si el electrón recibe suficiente energía, puede saltar a una órbita con un valor de n mayor, es decir, a un estado excitado. Pero este estado es inestable, por lo que el electrón pronto vuelve al estado fundamental, emitiendo un fotón en el proceso. La energía de este fotón es igual a la diferencia entre las energías de las dos órbitas.
Saltos cuánticos y espectros atómicos
Los niveles de energía en los átomos se asemejan a escaleras con distancias variables entre los peldaños. Los electrones no pueden existir entre los niveles de energía, de la misma manera que no se puede estar de pie entre los peldaños de una escalera. Saltar a cada peldaño o nivel requiere una cantidad específica y discreta de energía, y bajar un peldaño o nivel libera la misma cantidad de energía.
Un electrón puede excitarse a cualquier nivel de energía, n, y regresar a cualquier nivel de energía inferior. Cuando un electrón regresa a n = 2, se emite luz visible. La línea roja en el espectro tiene una energía menor porque proviene de un salto más pequeño (por ejemplo, de n = 3 a n = 2) en comparación con una línea violeta, que proviene de un salto más grande (por ejemplo, de n = 6 a n = 2).
Transiciones electrónicas y emisión de fotones
Los electrones que caen al nivel más bajo, n = 1 emiten luz ultravioleta, que tiene una energía mayor. Los electrones que caen a n = 3 emiten luz en el infrarrojo, que tiene una energía menor.
Es importante recordar que los electrones solo absorben o emiten la cantidad exacta de energía necesaria para moverse entre niveles de energía permitidos. No pueden absorber energía extra, y si la energía es insuficiente, no se moverán.
Capacidad electrónica de los niveles de energía
Los niveles de energía más cercanos al núcleo contienen menos electrones. El número máximo de electrones en un nivel de energía n se calcula con la fórmula 2n2. Por ejemplo:
- n = 1 puede contener hasta 2 electrones.
- n = 2 puede contener hasta 8 electrones.
- n = 3 puede contener hasta 18 electrones.
- n = 4 puede contener hasta 32 electrones.
