Objetivo de aprendizaje
Comprender y utilizar los números cuánticos para describir los electrones en un átomo.
1. Limitaciones del modelo atómico de Bohr
El modelo de Bohr fue un intento de explicar los estados de energía de los electrones en los átomos. Este modelo se basaba en la cuantización, la idea de que los electrones existen en niveles de energía discretos. Según Bohr, los espectros de emisión del hidrógeno consistían en líneas estrechas porque las longitudes de onda de estas líneas correspondían a las diferencias en los niveles de energía permitidos.
Sin embargo, este modelo tenía varios problemas e ideas incorrectas:
- El modelo no podía predecir los espectros de emisión de elementos que tuvieran más de un electrón. Solo funcionaba bien con el átomo de hidrógeno.
- Asumía que el electrón era una partícula subatómica en una órbita fija alrededor del núcleo.
- No podía explicar el efecto de los campos eléctricos y magnéticos en las líneas espectrales de átomos e iones.
- No podía explicar cómo se formaban los enlaces moleculares ni la geometría de las moléculas.
- El principio de incertidumbre de Heisenberg establece que es imposible conocer con precisión la ubicación y el momento de un electrón al mismo tiempo. El modelo de Bohr asumía que los electrones tenían un momento fijo en órbitas circulares específicas.
Debido a estas limitaciones, el modelo de Bohr fue eventualmente reemplazado por el modelo mecánico cuántico del átomo.
2. Modelo mecánico cuántico
Las funciones de onda de Schrödinger describen a los electrones en los átomos en términos de su densidad de probabilidad, utilizando la idea de Heisenberg de que la posición y el momento de los electrones son inciertos. En lugar de decir que los electrones siguen un camino definido, esta teoría nos da la probabilidad de encontrar un electrón en una región específica del espacio, a cierta distancia del núcleo. Un orbital atómico es una región en el espacio donde hay una alta probabilidad de encontrar un electrón.
Existen varios tipos de orbitales atómicos, y cada uno puede contener un máximo de dos electrones. Cada orbital tiene una forma y energía características. Los primeros cuatro orbitales atómicos, en orden de energía creciente, se etiquetan como s, p, d y f. Los orbitales posteriores son teóricos y se etiquetan alfabéticamente (g, h, i, k, etc.).
3. Números cuánticos y orbitales
Los números cuánticos son una parte fundamental de la mecánica cuántica, la teoría que describe el comportamiento de los electrones en los átomos. Estos números permiten identificar el estado de un electrón dentro de un átomo, determinando su energía, su forma de onda y su orientación en el espacio.
Estos números cuánticos son derivados de la solución de la ecuación de Schrödinger para el átomo de hidrógeno y son aplicables a todos los elementos.
Comprender los números cuánticos es esencial para interpretar la estructura electrónica de los átomos y predecir sus propiedades químicas.
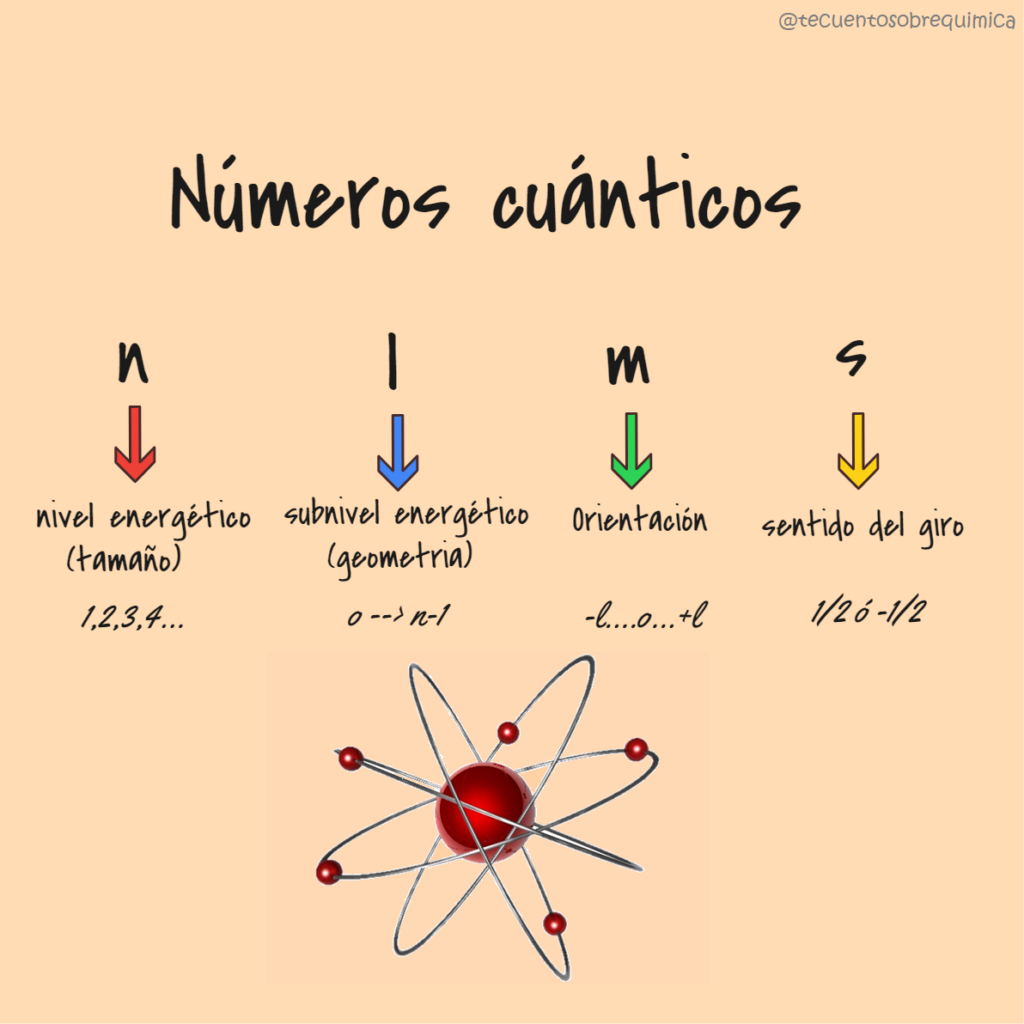
Los cuatro números cuánticos son:
- Número cuántico principal (n): Describe el nivel de energía principal en el que se encuentra el electrón. Es un número entero positivo (n = 1, 2, 3,…), donde un valor más alto de n indica una mayor distancia promedio del electrón al núcleo y una mayor energía.
- Número cuántico secundario o azimutal (l): Describe la forma del orbital en el que reside el electrón. Su valor depende del número cuántico principal, y toma valores enteros desde 0 hasta (n-1). Los valores de l están asociados a los diferentes tipos de orbitales: s (l=0), p (l=1), d (l=2), y f (l=3).
- Número cuántico magnético (ml): Describe la orientación espacial del orbital. Su valor varía desde –l hasta +l, incluyendo el cero. Este número determina la orientación de los orbitales en el espacio y cuántos orbitales de un mismo tipo (p, d, f) están disponibles en un nivel de energía dado.
- Número cuántico de espín (ms): Describe el sentido del giro (espín) del electrón sobre su propio eje. Solo puede tomar dos valores: +1/2 o -1/2, indicando los dos posibles estados de espín del electrón, que son responsables del comportamiento magnético de los átomos.
Ejercicio 1: Determinar los números cuánticos para un electrón en el orbital 3p.
Solución:
- n = 3 (nivel de energía principal)
- l = 1 (orbital p)
- ml = -1, 0, +1 (tres posibles orientaciones del orbital p)
Ejercicio 2: ¿Cuántos electrones pueden ocupar el nivel de energía n=4?
Solución:
Para n=4, l puede tomar valores de 0 a 3. Esto corresponde a los subniveles s (l=0), p (l=1), d (l=2), y f (l=3).
Los números cuánticos magnéticos ml varían entre –l y +l, lo que da un número de orbitales en cada subnivel de:
s: 1 orbital
p: 3 orbitales
d: 5 orbitales
f: 7 orbitales
Cada orbital puede tener 2 electrones (uno para cada espín), por lo que:
s: 2 electrones
p: 6 electrones
d: 10 electrones
f: 14 electrones
En total, el nivel n=4 puede albergar 32 electrones.
Analogía de la ubicación probable
Imagina que eres un estudiante esperando que comience tu clase de química a las 8:00 a.m. A las 8:15 a.m., todavía no hay señales de tu maestro, por lo que te preguntas dónde podría estar. Algunos compañeros sugieren que el maestro:
- Podría estar en la sala de profesores, el laboratorio de química o la biblioteca.
- Podría estar en la oficina del director o en el estacionamiento de la escuela.
- Tal vez esté en su casa en el centro de la ciudad.
- Podría estar en el aeropuerto.
- ¡Incluso podría haber ido al Polo Norte!
Aunque no se sabe la ubicación exacta del maestro, es posible dibujar un grupo tridimensional de puntos que muestren áreas donde hay una alta probabilidad de encontrarlo. Podría dibujarse una superficie límite alrededor de este grupo para definir una región en el espacio donde hay un 99% de probabilidad de encontrarlo. Esta podría ser el perímetro de la escuela, la ciudad donde se encuentra tu escuela, o una cierta región alrededor de la ciudad que incluya el aeropuerto. De manera similar, un orbital atómico representa la región del espacio con una alta probabilidad de encontrar un electrón.
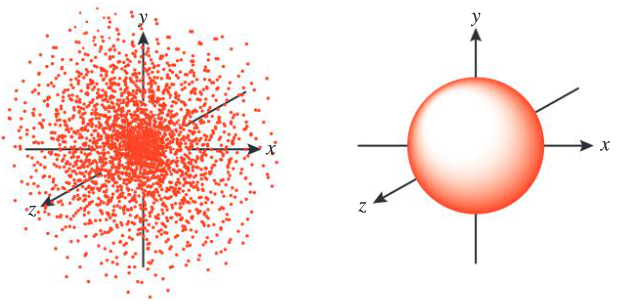
Representación de un orbital atómico 1s como un conjunto de puntos (izquierda) y una esfera que encierra el 99% de los puntos (derecha).
Orbitales p
Un orbital p tiene forma de mancuerna. Hay tres orbitales p, cada uno descrito con orientaciones paralelas a los ejes x, y y z. Estos se etiquetan como px, py y pz. Estas formas describen los límites con la mayor probabilidad de encontrar electrones en estos orbitales.
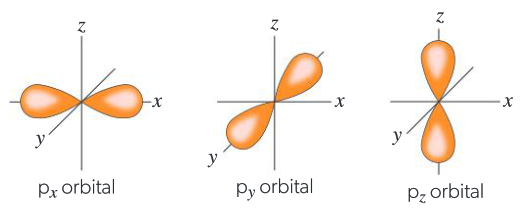
Los tres orbitales atómicos p tienen forma de mancuerna y están alineados a lo largo de los ejes x, y y z. Hay una probabilidad nula de encontrar el electrón en la intersección de los ejes entre los dos lóbulos de la mancuerna. Cada uno de los orbitales p puede albergar dos electrones.
Ejercicios de práctica
1. Cuál es el número máximo de electrones de un átomo que pueden tener los siguientes números:
a) n = 2
b) n = 3; l=1 y ml = 0
2. ¿Cuál de los siguientes estados cuánticos no es posible para el electrón de un átomo?
a) (4,3,3,-1/2)
b) (5,0,0,0)
c) (3,2,2,1/2)
