
Una muestra el cambio físico de hielo derritiéndose en agua, y la otra un cambio químico de papel quemándose en cenizas y humo.
La materia puede experimentar dos tipos principales de cambios: físicos y químicos. Entender la diferencia entre estos dos tipos de cambios es esencial para el estudio de la química y para reconocer cómo y por qué las sustancias se transforman.
Objetivo de aprendizaje
- Distinguir entre cambios físicos y químicos de la materia.
- Identificar ejemplos de cada tipo de cambio.
1. Cambios físicos
Los cambios físicos son aquellos que afectan las propiedades físicas de una sustancia sin alterar su composición química. Durante un cambio físico, las moléculas de la sustancia permanecen intactas y no se forman nuevas sustancias.
Ejemplos:
- Cambio de estado: Sólido a líquido, líquido a gas, etc. (Ejemplo: Hielo que se derrite)
- Corte: Cortar un trozo de papel en pedazos más pequeños.
- Disolución: Disolver sal en agua.
- Deformación: Estirar una banda elástica.
Un estado de la materia no siempre es permanente. Los cambios en la temperatura o presión que afectan a la materia se llaman cambios de estado. Estos son:
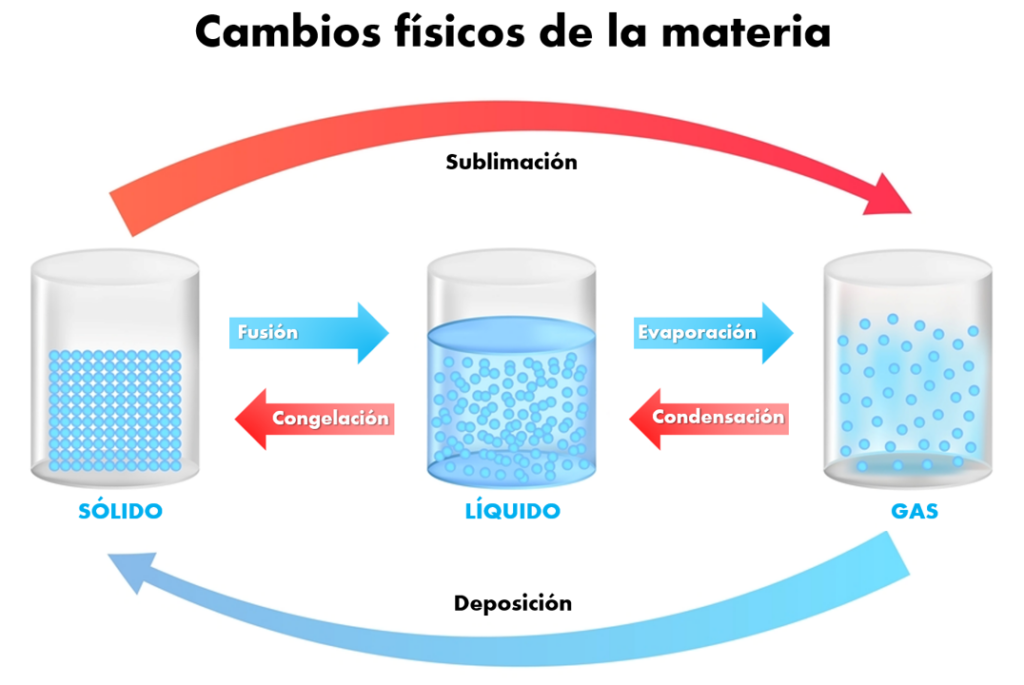
A. Fusión
Es el proceso por el cual una sustancia cambia de estado sólido a estado líquido. Esto ocurre cuando se añade suficiente energía térmica para romper las fuerzas de atracción entre las partículas en un sólido, permitiendo que se muevan más libremente en el estado líquido.
- Ejemplo: Derretimiento del hielo. Cuando se calienta el hielo (agua en estado sólido), absorbe energía térmica y se convierte en agua líquida.
El punto de fusión es la temperatura a la cual una sustancia pasa de sólido a líquido a presión atmosférica normal. Por ejemplo, consideremos el punto de fusión del hielo: 0°C (32°F).
B. Congelación
Definición: La congelación es el proceso por el cual una sustancia cambia de estado líquido a estado sólido. Esto ocurre cuando se elimina suficiente energía térmica de una sustancia líquida para que las partículas se acerquen y formen una estructura ordenada de sólido.
- Ejemplo: Congelación del agua. Cuando se enfría el agua líquida, libera energía térmica y se convierte en hielo (agua en estado sólido).
El punto de congelación es la temperatura a la cual una sustancia pasa de líquido a sólido a presión atmosférica normal. Por ejemplo, el punto de congelación del agua es 0°C (32°F).
C. Evaporación
Es el proceso por el cual una sustancia cambia de estado líquido a estado gaseoso. Esto ocurre cuando las partículas en la superficie de un líquido ganan suficiente energía para escapar y convertirse en gas.
- Ejemplo: Evaporación del agua. Cuando el agua líquida se calienta, algunas partículas en la superficie ganan suficiente energía para convertirse en vapor de agua.
D. Condensación
Es el proceso por el cual una sustancia cambia de estado gaseoso a estado líquido. Esto ocurre cuando se elimina suficiente energía térmica de un gas para que las partículas se acerquen y formen un líquido.
- Ejemplo: Formación de gotas de agua en un vaso frío. Cuando el vapor de agua en el aire entra en contacto con la superficie fría del vaso, pierde energía térmica y se convierte en gotas de agua líquida.
E. Sublimación
Es el proceso por el cual una sustancia cambia directamente de estado sólido a estado gaseoso sin pasar por el estado líquido.
- Ejemplo: Sublimación del hielo seco (dióxido de carbono sólido). Cuando el hielo seco se expone a la atmósfera, pasa directamente de sólido a gas sin convertirse en líquido.
F. Deposición
Es el proceso por el cual una sustancia cambia directamente de estado gaseoso a estado sólido sin pasar por el estado líquido.
- Ejemplo: Formación de escarcha en ventanas frías. Cuando el vapor de agua en el aire entra en contacto con una superficie muy fría, se convierte directamente en cristales de hielo.
2. Cambios químicos
Los cambios químicos son aquellos que resultan en la formación de una o más sustancias nuevas con propiedades químicas y físicas diferentes de las originales. Durante un cambio químico, las moléculas de las sustancias originales se rompen y se reorganizan para formar nuevas moléculas.
Ejemplos:
- Combustión: Quemar madera en una chimenea.
- Oxidación: El hierro que se oxida y forma óxido (herrumbre).
- Descomposición: La descomposición de materia orgánica.
- Reacciones ácido-base: Mezclar bicarbonato de sodio con vinagre para producir dióxido de carbono.
3. ¿Cómo reconocer un cambio químico?
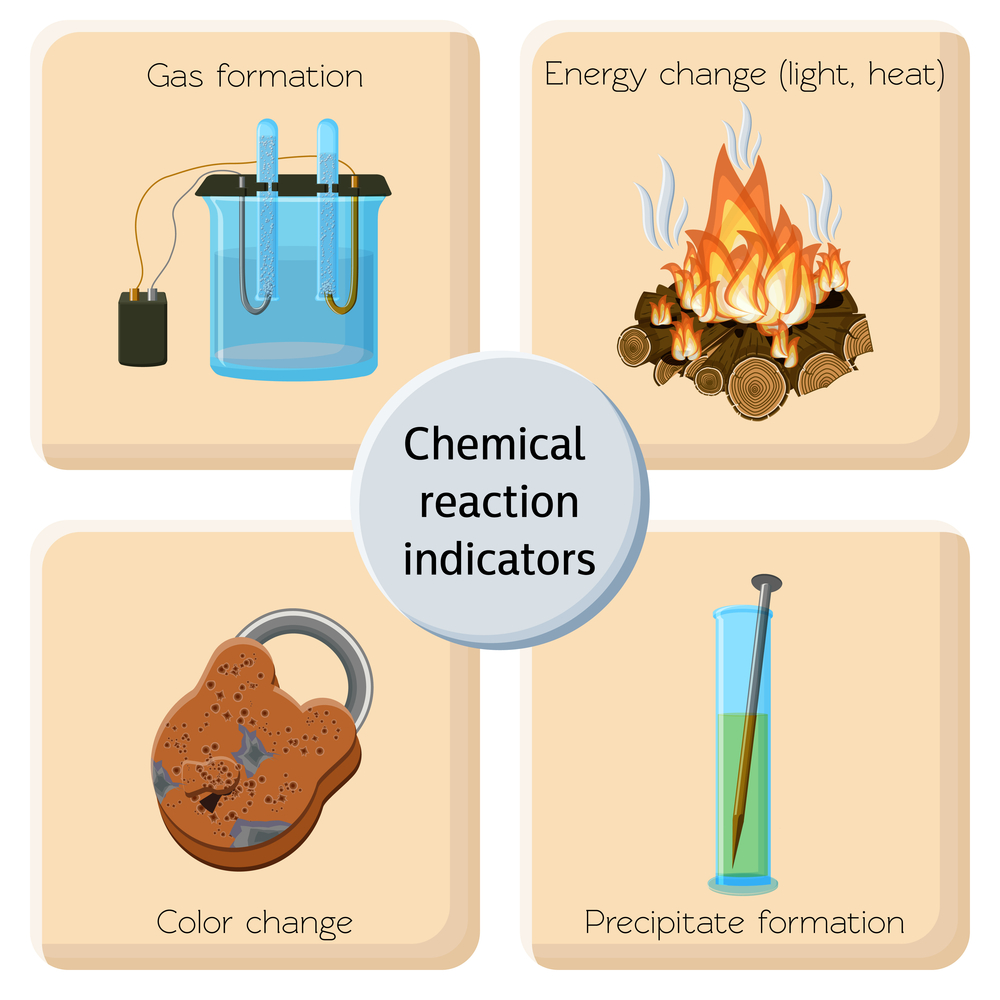
Para identificar si ha ocurrido un cambio químico, busca las siguientes señales:
A. Cambio en el color
Por ejemplo, cuando el hierro se oxida, cambia de color y se vuelve marrón rojizo.
B. Cambio en el olor
La formación de nuevos olores también puede ser un indicio de un cambio químico. Por ejemplo, cuando los alimentos se descomponen, suelen liberar olores desagradables debido a la formación de nuevas sustancias químicas.
C. Formación de un gas
La producción de burbujas o gas puede indicar que ha ocurrido un cambio químico. Un ejemplo clásico es la reacción entre el bicarbonato de sodio y el vinagre, que produce dióxido de carbono (CO₂) como gas.
D. Formación de un sólido
La formación de un precipitado (un sólido que se forma a partir de una solución líquida) puede ser evidencia de un cambio químico. Por ejemplo, cuando se mezclan soluciones de cloruro de sodio y nitrato de plata, se forma un precipitado blanco de cloruro de plata.
E. Cambio en la energía
Los cambios químicos suelen ir acompañados de cambios en la energía. Pueden ser:
- Exotérmico:
Un cambio exotérmico libera energía, generalmente en forma de calor. Un ejemplo es la combustión de la gasolina en un motor, que libera calor y luz.
- Endotérmico:
Un cambio endotérmico absorbe energía del entorno, generalmente en forma de calor. Un ejemplo es la descomposición del bicarbonato de sodio al ser calentado, que absorbe calor.
En resumen, la química estudia la materia y sus cambios, distinguiendo entre cambios físicos, que alteran la apariencia sin modificar la composición química (como congelar agua), y cambios químicos, que transforman sustancias en nuevas (como la oxidación del hierro). Estos conceptos son fundamentales para entender cómo las sustancias interactúan en nuestro entorno y tienen aplicaciones prácticas en la vida cotidiana, desde cocinar hasta soluciones sostenibles para desafíos ambientales.
Laboratorio: Cambios físicos y químicos
Objetivo:
- Identificar y diferenciar entre cambios físicos y cambios químicos mediante la observación de diversas reacciones y transformaciones de la materia.
Materiales:
Sustancias
- Agua
- Sal
- Vinagre
- Bicarbonato de sodio
- Azúcar
- Aceite
- Papel de filtro
- Trozo de papel
Materiales y equipos
- Vasos de precipitados
- Tubos de ensayo
- Soporte para tubos de ensayo
- Mechero Bunsen
- Pinzas
- Termómetro
- Cuchara
- Placa de Petri
- Balón de vidrio
- Varilla de vidrio
- Papel tornasol o indicador de pH
- Encendedor
- Plato metálico pequeño
Procedimiento:
Parte 1. Combustión
- Observe la apariencia de un fragmento de cinta de magnesio
- Agregue unas gotas de agua al producto. Responda: ¿Es soluble?
- Vea el pH con papel tornasol o papel pH. Anote el pH.
- Sujete la cinta de magnesio por un extremo con las pinzas y caliente el otro extremo directamente en la llama de un mechero de alcohol. Observa el producto de la combustión en una cápsula de porcelana
- ¿Observa algún cambio? Describa el cambio que observa y el producto
- Agregue unas gotas al producto. Responda: ¿Es soluble?
- Observe qué pH tiene con un papel tornasol rojo o papel pH.
- Repita el procedimiento con un fósforo.
Parte 2. Ensayo con sulfato de cobre y un clavo
- Haga observaciones iniciales al proceso del clavo y la solución de sulfato de cobre
- Anote el olor, el color, el pH, su solubilidad.
- Coloque en un tubo de ensayo 5 mL de solución de sulfato de cobre
- Cuidadosamente incline el tubo y coloque el clavo de hierro para ponerlo en contacto con la solución
- Dejar reposar por 15 minutos. Responda: ¿Qué observa?
- Agite el tubo sutilmente para desprender cualquier residuo del clavo.
- Retire con cuidado el clavo y examínelo.
- Note el color de la solución en el tubo y el clavo. Haga sus observaciones y anótelas.
- Filtre la solución y examine el residuo que queda en el papel filtro. Haga sus observaciones y anótelas.
Parte 3. Estados físicos
- Parta un trozo de hielo en tres pedazos de tamaño similar o tome tres cubos de hielo de igual tamaño.
- Divida los trozos en masas similares en tres vasos de precipitados. Anote las masas de cada trozo de hielo.
- Guarde uno en la hielera o congelador y los otros dos colóquelos a temperatura ambiente. Después de 30 minutos, saque el hielo del congelador y déjelo reposar a temperatura ambiente por 5 minutos y encienda la estufa para calentar uno de los vasos de precipitación de los que dejó reposar a temperatura ambiente.
- Determine la temperatura del agua en en cada uno de los recipientes con un termómetro. Compare los resultados.
- Compare el volumen de agua en los tres recipientes midiéndolos con una probeta.
- Coloque un trozo de hielo en el recipiente de agua a temperatura ambiente y anote sus observaciones después de cinco minutos. Responda: ¿Qué tipo de cambio ha ocurrido? ¿A qué se debe el cambio?
Parte 4. Evaporación
- Coloque 2 mL de agua en un tubo de ensayo caliente en baño maría por 10 minutos
- Coloque 2 mL de alcohol en un tubo de ensayo, caliente en baño maría por 10 minutos.
- Compare el volumen entre los tubos de ensayo después de secado. Anote sus observaciones.
Tabla de resultados:
| Experimento | Observaciones Iniciales | Observaciones Finales | Tipo de Cambio |
|---|---|---|---|
| Combustión | |||
| Ensayo con sulfato de cobre y un clavo | |||
| Estados físicos | |||
| Evaporación |
Discusión de resultados:
- ¿Qué observaste en cada experimento al final del procedimiento?
- ¿Cómo puedes determinar si un cambio es físico o químico?
- ¿Qué evidencias indican que se produjo un cambio químico en la reacción entre el sulfato de cobre y el clavo?
- ¿Por qué la evaporación se considera un cambio físico?
Conclusiones:
- ¿Qué diferencia hay entre un cambio físico y un cambio químico en términos de la estructura de las moléculas involucradas?
- ¿Por qué la combustión se clasifica como un cambio químico?
- Da un ejemplo adicional de un cambio físico y uno de un cambio químico que no se haya realizado en esta práctica. Explica con tus propias palabras.
- ¿Cómo se podría revertir cada uno de los cambios físicos observados en esta práctica? ¿Es posible revertir los cambios químicos?
