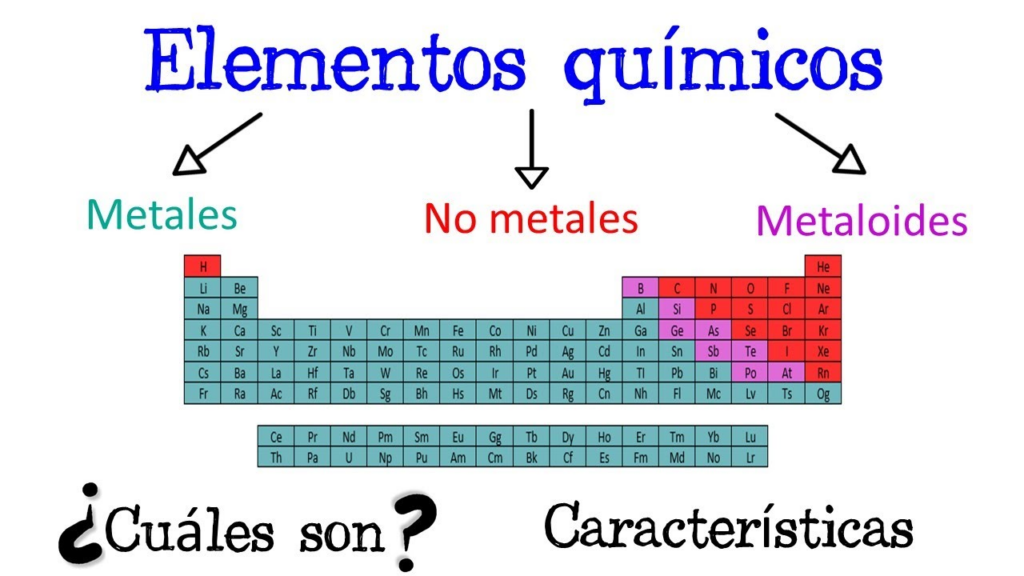
En esta nueva lección aprenderás sobre tres grupos muy importantes de elementos en la tabla periódica: metales, no metales y metaloides. Estos grupos son esenciales para entender cómo funcionan los materiales que usamos a diario.
Objetivo de aprendizaje
Identificar y comparar las propiedades de los metales, no metales y metaloides mediante un análisis de sus características y ejemplos representativos.
1. Definición de metales, no metales y metaloides (semimetales)
- Metales: Son elementos que tienen la capacidad de conducir electricidad y calor. Son maleables (se pueden moldear) y dúctiles (se pueden estirar en hilos). Un ejemplo clásico de metal es el hierro (Fe).
- No Metales: Son elementos que no conducen bien el calor ni la electricidad. Suelen ser frágiles si son sólidos, o pueden presentarse en forma de gases. Un ejemplo de no metal es el oxígeno (O2).
- Metaloides: Son elementos que tienen propiedades intermedias entre los metales y los no metales. Pueden comportarse como metales en algunas situaciones y como no metales en otras. Un ejemplo de metaloide es el silicio (Si).
2. Características principales:
| Propiedad | Metales | No Metales | Metaloides |
|---|---|---|---|
| Conducción eléctrica | Muy buena | Mala | Intermedia (dependiendo de las condiciones) |
| Conducción térmica | Muy buena | Mala | Intermedia |
| Apariencia | Brillante | Mate o sin brillo | Brillante o mate, depende del estado |
| Maleabilidad | Alta (se pueden moldear) | Baja (tienden a romperse) | Baja o intermedia |
| Estado físico | Sólidos (excepto mercurio) | Gases, sólidos frágiles o líquidos | Generalmente sólidos |
| Ductilidad | Alta (se pueden estirar en hilos) | Baja | Intermedia |
| Ejemplos | Hierro (Fe), Cobre (Cu), Oro (Au) | Oxígeno (O2), Azufre (S), Cloro (Cl) | Silicio (Si), Boro (B), Arsénico (As) |
3. Ejemplos comunes:
- Metales: Oro (Au), Aluminio (Al), Zinc (Zn), Hierro (Fe), Plata (Ag).
- No Metales: Nitrógeno (N), Fósforo (P), Cloro (Cl), Azufre (S), Carbono (C).
- Metaloides: Silicio (Si), Boro (B), Germanio (Ge), Arsénico (As), Antimonio (Sb).
