
La tabla periódica es una herramienta fundamental en química que organiza los elementos de acuerdo con sus propiedades químicas y físicas. Estas propiedades no solo nos permiten identificar y clasificar los elementos, sino también predecir su comportamiento en diferentes reacciones químicas.
En esta lección, exploraremos las propiedades periódicas más importantes, cómo varían a lo largo de un período y un grupo, y cómo estas tendencias nos ayudan a entender mejor la naturaleza de los elementos.
Objetivo de aprendizaje
- Comprender y explicar las propiedades periódicas de los elementos y sus tendencias a lo largo de la tabla periódica.
1. Radio atómico
El radio atómico es la distancia promedio entre el núcleo del átomo y la capa de electrones más externa. Este radio se puede medir en picómetros (pm), donde 1 pm equivale a 10−12 metros.
Tendencias periódicas del radio atómico:
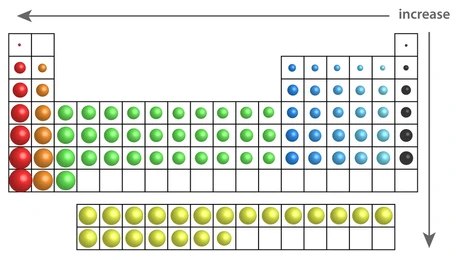
- A lo largo de un período (de izquierda a derecha):
A medida que avanzamos de izquierda a derecha en un período de la tabla periódica, el radio atómico disminuye. Esto ocurre porque, aunque los átomos ganan más protones en el núcleo, lo que aumenta la carga nuclear positiva, no se agregan nuevas capas de electrones. La mayor carga nuclear atrae los electrones más cerca del núcleo, lo que reduce el radio atómico.
- Dentro de un grupo (de arriba a abajo):
A medida que bajamos en un grupo de la tabla periódica, el radio atómico aumenta. Esto se debe a que cada elemento en un grupo tiene una capa adicional de electrones en comparación con el elemento anterior. Aunque la carga nuclear también aumenta, el efecto de la repulsión entre electrones en las capas internas hace que los electrones externos se encuentren más lejos del núcleo, aumentando el tamaño del átomo.
Ejemplo 1: Indica cuál de los siguientes elementos tiene el mayor radio atómico y explica tu elección.
a) Mg o S
b) Li o Cs
Solución:
a) Mg. En el mismo período, el radio atómico disminuye de izquierda a derecha debido a un aumento en la carga nuclear, lo que atrae los electrones más cerca del núcleo. Por lo tanto, Mg, que está más a la izquierda, tiene un radio mayor que S.
b) Cs. En el mismo grupo, el radio atómico aumenta de arriba hacia abajo debido al incremento en el número de capas electrónicas. Por lo tanto, Cs, que está más abajo en el grupo, tiene un radio mayor que Li.
Ejemplo 2: Ordena los siguientes elementos en orden de mayor a menor radio atómico: Al, Si, P.
Solución:
Estos elementos están en el mismo período (tercer período) y, según la tendencia, el radio atómico disminuye de izquierda a derecha. Por lo tanto, el orden de mayor a menor radio atómico sería: Al > Si > P.
2. Primera energía de ionización
La primera energía de ionización es la cantidad de energía que se requiere para remover el electrón más externo de un átomo neutro en estado gaseoso, resultando en la formación de un ion positivo (catión). Matemáticamente, se puede representar así:
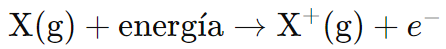
Donde X representa un átomo del elemento en estado gaseoso.
Tendencias de la primera energía de ionización en la tabla periódica
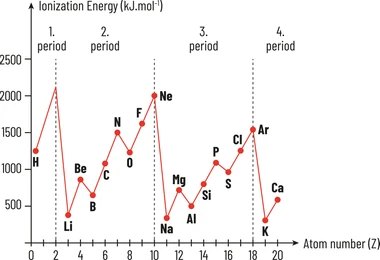
- A lo largo de un período (de izquierda a derecha)
A medida que avanzamos de izquierda a derecha a través de un período en la tabla periódica, la primera energía de ionización generalmente aumenta. Esto se debe a que el número de protones en el núcleo aumenta, lo que incrementa la carga nuclear positiva. Como resultado, los electrones en el nivel de energía más externo son atraídos con más fuerza hacia el núcleo, y se requiere más energía para eliminarlos.
- De arriba hacia abajo en un grupo
Al descender en un grupo en la tabla periódica, la primera energía de ionización generalmente disminuye. Aunque la carga nuclear positiva aumenta (más protones), los electrones de valencia están más alejados del núcleo y son más fáciles de remover debido a la mayor distancia y al efecto de apantallamiento ejercido por los electrones internos.
Ejemplo 3: Indica cuál de los siguientes elementos tiene la mayor primera energía de ionización y explica por qué:
a) Na o Cl
b) Mg o K
Solución:
a) Cl tiene la mayor primera energía de ionización. Al moverse de izquierda a derecha en un período, el cloro tiene más protones que el sodio, lo que aumenta la atracción sobre sus electrones de valencia. Como resultado, se requiere más energía para remover un electrón de cloro que de sodio.
b) Mg tiene la mayor primera energía de ionización. Aunque ambos elementos están en el grupo 2, el magnesio está más arriba en la tabla periódica que el potasio. Esto significa que sus electrones de valencia están más cerca del núcleo y son más difíciles de remover, lo que resulta en una mayor energía de ionización para el magnesio.
3. Afinidad electrónica
La afinidad electrónica es la energía liberada cuando un átomo en estado gaseoso acepta un electrón adicional. Esta energía generalmente se expresa en unidades de kJ/mol. Cuanto más negativa sea la afinidad electrónica, mayor será la tendencia del átomo a aceptar un electrón.

Tendencias de la afinidad electrónica en la tabla periódica
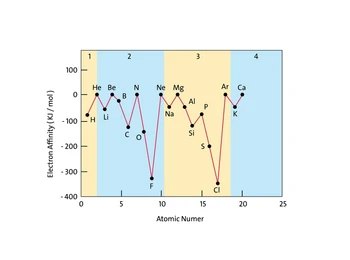
- A lo largo de un período (de izquierda a derecha)
Al movernos de izquierda a derecha en un período, la afinidad electrónica generalmente se vuelve más negativa. Esto se debe a que los átomos hacia la derecha de la tabla periódica (como los halógenos) tienen una mayor necesidad de ganar un electrón para completar su capa de valencia y alcanzar una configuración más estable. Por ejemplo, el flúor tiene una afinidad electrónica muy negativa, lo que significa que libera mucha energía al ganar un electrón.
- De arriba hacia abajo en un grupo
Al movernos de arriba hacia abajo en un grupo, la afinidad electrónica generalmente se vuelve menos negativa. Esto sucede porque, a medida que los átomos se vuelven más grandes (con más capas de electrones), el electrón agregado se encuentra más lejos del núcleo y es menos atraído por la carga nuclear positiva. Por lo tanto, se libera menos energía cuando el átomo gana un electrón.
Ejemplo 4: ¿Cuál de los siguientes elementos tiene una afinidad electrónica más negativa, cloro (Cl) o sodio (Na)?
Solución:
El cloro (Cl) está más a la derecha en el mismo período que el sodio (Na), lo que significa que tiene una mayor tendencia a ganar un electrón. Por lo tanto, la afinidad electrónica del cloro es más negativa que la del sodio.
Ejemplo: Ordena los siguientes elementos según su afinidad electrónica, de menos negativa a más negativa: flúor (F), bromo (Br), yodo (I).
Solución:
Al moverse de arriba a abajo en el grupo de los halógenos, la afinidad electrónica se vuelve menos negativa. Así, el orden es I < Br < F, donde el flúor tiene la afinidad electrónica más negativa.
4. Electronegatividad
La electronegatividad es la capacidad de un átomo para atraer electrones hacia sí mismo cuando está unido a otro átomo en un enlace químico. En otras palabras, mide cuán fuerte es la atracción que un átomo ejerce sobre los electrones compartidos en un enlace químico. Este concepto es fundamental para entender la polaridad de los enlaces y las interacciones entre átomos en moléculas.
La electronegatividad fue propuesta por Linus Pauling y se mide en una escala conocida como la escala de Pauling. En esta escala, el flúor (F) tiene la mayor electronegatividad, con un valor de 4.0, mientras que los metales alcalinos y algunos metales de transición tienen electronegatividades muy bajas.
Tendencias de la electronegatividad en la tabla periódica
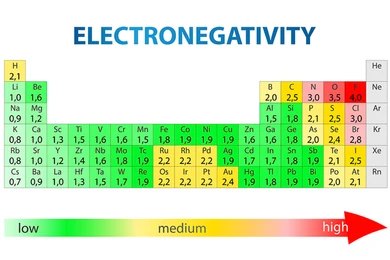
- A lo largo de un período (de izquierda a derecha)
La electronegatividad aumenta a medida que avanzamos de izquierda a derecha en un período de la tabla periódica. Esto se debe a que, a medida que aumenta el número de protones en el núcleo, la carga nuclear efectiva aumenta, lo que permite al átomo atraer con más fuerza los electrones hacia sí mismo en un enlace químico.
Por ejemplo, en el Período 2, el litio (Li) tiene una electronegatividad baja, mientras que el flúor (F) tiene la electronegatividad más alta.
- De arriba hacia abajo en un grupo
La electronegatividad disminuye a medida que descendemos en un grupo de la tabla periódica. Esto ocurre porque los electrones de valencia están más alejados del núcleo debido a los niveles adicionales de electrones, lo que reduce la capacidad del átomo para atraer electrones en un enlace químico.
Por ejemplo, en el Grupo 17 (halógenos), el flúor (F) es el más electronegativo, mientras que el yodo (I) es mucho menos electronegativo.
Ejemplo 5: Ordena los siguientes elementos en términos de su electronegatividad, de menor a mayor:
a) C, O, F, N
b) Li, K, Cs, Na
c) S, O, P, Cl
Solución:
a) En el período 2, la electronegatividad aumenta de izquierda a derecha. El orden correcto es: C < N < O < F.
b) En el grupo 1, la electronegatividad disminuye al descender en el grupo. El orden correcto es: Cs < K < Na < Li.
c) Dentro del período 3, la electronegatividad aumenta de izquierda a derecha. El orden correcto es: P < S < O < Cl.
5. Carácter metálico
El carácter metálico se refiere a la tendencia de un átomo a perder electrones de valencia fácilmente.
El carácter metálico es más común en los elementos del lado izquierdo de la tabla periódica (metales) y disminuye al avanzar de izquierda a derecha en un período. Los elementos del lado derecho de la tabla periódica (no metales) no pierden electrones fácilmente, lo que significa que son menos metálicos. La mayoría de los metaloides, que se encuentran entre los metales y no metales, tienden a perder electrones, pero no tan fácilmente como los metales.
Tendencias del carácter metálico en la tabla periódica
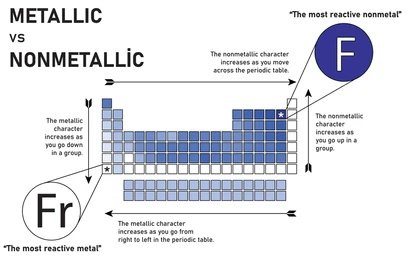
- A lo largo de un período (de izquierda a derecha)
A medida que avanzamos de izquierda a derecha a lo largo de un período en la tabla periódica, el carácter metálico disminuye. Esto se debe a que el número de protones en el núcleo aumenta, lo que incrementa la atracción entre el núcleo y los electrones de valencia. Como resultado, los electrones de valencia se vuelven más difíciles de perder, reduciendo así el carácter metálico.
Por ejemplo, el sodio (Na) en el grupo 1 tiene un carácter metálico más fuerte que el cloro (Cl) en el grupo 17.
- De arriba hacia abajo en un grupo
A medida que descendemos en un grupo, el carácter metálico aumenta. Esto ocurre porque, aunque el número de protones en el núcleo también aumenta, los electrones de valencia están en niveles de energía más alejados del núcleo. Este mayor alejamiento reduce la atracción del núcleo sobre los electrones de valencia, facilitando su pérdida.
Por ejemplo, el cesio (Cs) en el grupo 1 tiene un carácter metálico más fuerte que el litio (Li) en el mismo grupo.
Ejemplo 6: Ordena los siguientes elementos según su carácter metálico, de mayor a menor: Na, Al, P, Cl.
Solución:
A lo largo del Período 3, el carácter metálico disminuye de izquierda a derecha. Por lo tanto, el orden de mayor a menor carácter metálico es: Na > Al > P > Cl.
Ejemplo 7: ¿Cuál de los siguientes elementos tiene un carácter metálico más fuerte: Mg o Ba?
Solución:
Mg (magnesio) y Ba (bario) están en el mismo grupo (grupo 2) de la tabla periódica. A medida que descendemos en un grupo, el carácter metálico aumenta. Por lo tanto, el bario (Ba) tiene un carácter metálico más fuerte que el magnesio (Mg).
Ejemplo 8: ¿Cuál de los siguientes elementos es más metálico: Si o Ge?
Solución:
Ambos elementos, Si (silicio) y Ge (germanio), pertenecen al grupo 14. Ge está más abajo en el grupo que Si, lo que significa que Ge tiene un carácter metálico más fuerte que Si.
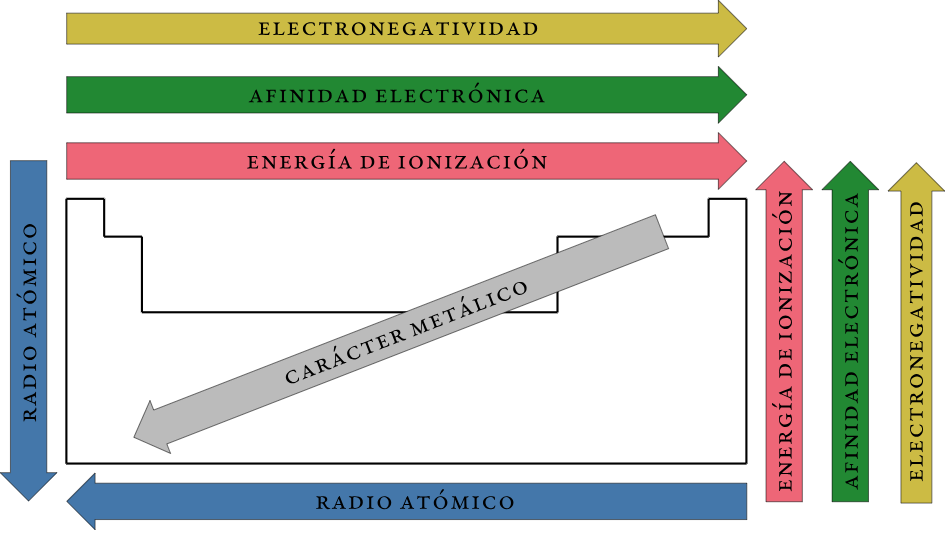
Resumen de las tendencias en las propiedades periódicas
Ejemplos y Ejercicios
- Ejercicio de Comparación de Radio Atómico:
Compara el radio atómico de los elementos sodio (Na) y cloro (Cl). Explica por qué el cloro tiene un radio atómico menor que el sodio. - Ejercicio de Energía de Ionización:
Ordena los siguientes elementos según su primera energía de ionización, de menor a mayor: potasio (K), magnesio (Mg), fósforo (P), argón (Ar). Explica las razones detrás de este orden. - Ejercicio de Afinidad Electrónica:
Compara la afinidad electrónica del oxígeno (O) y el flúor (F). Explica por qué el flúor tiene una afinidad electrónica más negativa que el oxígeno.
Actividades Autodidactas y Creativas
- Mapa Interactivo de Propiedades Periódicas:
Los estudiantes pueden crear un mapa interactivo usando herramientas digitales, como un software de presentación o una aplicación de mapeo conceptual, para mostrar cómo varían las propiedades periódicas a lo largo de la tabla periódica. El mapa debe incluir ejemplos específicos y explicaciones para cada propiedad. - Juego de Tarjetas de Propiedades Periódicas:
Crear un juego de tarjetas donde cada tarjeta tenga un elemento y una propiedad periódica asociada. Los estudiantes deben organizar las tarjetas en orden según las tendencias periódicas. Este juego puede hacerse en equipos para fomentar la colaboración. - Experimento de Visualización de Propiedades:
Diseñar un experimento simple que permita a los estudiantes observar las diferencias en reactividad entre un metal alcalino (como el sodio) y un halógeno (como el cloro), ilustrando la variación en el carácter metálico y la electronegatividad.
Esta estructura de clase con metodología K-learning está diseñada para facilitar el aprendizaje interactivo y comprensivo de las propiedades periódicas, empleando tanto teoría sólida como actividades prácticas que refuercen el entendimiento de los estudiantes sobre este tema clave en la química.
